Досягнення моделі будови електронних оболонок атомів – Модель будови електронних оболонок атомів
БУДОВА АТОМА
5 . Модель будови електронних оболонок атомів
Основні припущення теорії Бора можна перенести в якісному відношенні на прості системи з декількома валентними електронами, наприклад, такі як атоми лужних металів.
– Електрони розташовуються навколо ядра на оболонках (шарах).
– Усього в атомах розрізняють до семи оболонок (шарів).
– Кожна оболонка є певним рівнем енергії і може містити певне число електронів.
Запам’ятайте: загальна формула, що визначає максимальне число електронів в оболонці, –
Максимальне число електронів заповнених електронних оболонок
Номер оболонки = квантове число | Позначення оболонки | Максимальне число електронів |
1 | К | 2 |
2 | L | 8 |
3 | М | 18 |
4 | N | 32 |
5 | О | 50 |
6 | Р | 72 |
7 | Q | 98 |
Кожен атом елемента має певне число електронних
– зовнішню оболонку називають оболонкою валентних електронів;
– електрони, які знаходяться на оболонці валентних електронів, називають валентними електронами.
Прилад. Модель атома Алюмінію
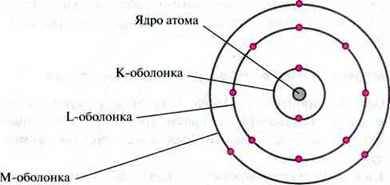
Валентні електрони відповідають за хімічні властивості елементів, а також за хімічний зв’язок між атомами.
Досягнення моделі будови електронних оболонок атомів
– визначено відносні розміри атомів різних елементів;
– пояснено різну енергію іонізації атомів;
– обгрунтовано і передбачено різну реакційну здатність елементів;
– обгрунтовано здатність утворювати зв’язок між атомами елементів (іонний зв’язок, ковалентний зв’язок).
Related posts:
- Будова електронних оболонок атомів і структура Періодичної системи Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ БУДОВА АТОМА Будова електронних оболонок атомів і структура Періодичної системи Число хімічних елементів у періодах Структура Періодичної системи повністю обумовлюється принципами будови електронної оболонки атомів. Число хімічних елементів, що містяться в кожному періоді, визначається місткістю відповідних енергетичних шарів. Число орбіталей на кожному енергетичному […]...
- Будова електронних оболонок атомів. Енергетичні рівні й підрівні Тема 3 ПЕРІОДИЧНИЙ ЗАКОН І ПЕРІОДИЧНА СИСТЕМА ХІМІЧНИХ ЕЛЕМЕНТІВ Д. І. МЕНДЕЛЄЄВА. БУДОВА АТОМА УРОК 47 Тема. Будова електронних оболонок атомів. Енергетичні рівні й підрівні Цілі уроку: розширити уявлення учнів про будову атомів; навчити складати електронні формули, схеми розподілу електронів по квантових комірках для елементів I-III періодів; формувати вміння учнів визначати електронну будову атома за […]...
- Будова електронних оболонок атомів РОЗДІЛ 1 ПОВТОРЕННЯ ТА ПОГЛИБЛЕННЯ ТЕОРЕТИЧНИХ ПИТАНЬ КУРСУ ХІМІЇ ОСНОВНОЇ ШКОЛИ § 4. Будова електронних оболонок атомів Усвідомлення змісту цього параграфа дає змогу: Пояснювати значення понять “електронна оболонка атома”, “квантове число”, “електронна конфігурація атома”; характеризувати закономірності розподілу електронів у атомах; складати схеми будови атомів, електронні формули атомів хімічних елементів і електронно-графічні формули. Пригадаємо, що атом […]...
- Будова електронних оболонок атомів ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 2. ПЕРІОДИЧНИЙ ЗАКОН Д. І. МЕНДЕЛЄЄВА І БУДОВА АТОМІВ § 2.6. Будова електронних оболонок атомів Тепер розглянемо будову окремо взятого електронного рівня (шару). Починаючи із значення головного квантового числа n = 2, енергетичні рівні (шари) поділяються на підрівні (підшари), що відрізняються […]...
- Будова електронних оболонок атомів Тема 3 ПЕРІОДИЧНИЙ ЗАКОН І ПЕРІОДИЧНА СИСТЕМА ХІМІЧНИХ ЕЛЕМЕНТІВ Д. І. МЕНДЕЛЄЄВА. БУДОВА АТОМА УРОК 48 Тема. Будова електронних оболонок атомів Цілі уроку: розвивати навички складання електронних формул, схем розподілу електронів по квантових комірках для елементів I-III періодів; продовжити формування вмінь і навичок учнів з визначення електронної будови атома за його положенням у періодичній системі […]...
- Стійкість електронних шарів. Перетворення атомів на йони – Електрон. Електронні шари ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 2. Будова атома 2.4. Електрон. Електронні шари 2.4.3. Стійкість електронних шарів. Перетворення атомів на йони Найстійкішою електронною конфігурацією атома є така, при якій у зовнішньому електронному шарі розміщується 2 (як р атома Гелію) або 8 е – (як в атомах інших інертних газів). […]...
- Ядерна модель будови атомів ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 2. ПЕРІОДИЧНИЙ ЗАКОН Д. І. МЕНДЕЛЄЄВА І БУДОВА АТОМІВ § 2.3. Ядерна модель будови атомів До кінця XIX ст. атоми вважалися неподільними. Потім, з нагромадженням експериментальних даних, довелося відмовитися від такого погляду і визнати, що атоми мають складну будову. Новий погляд […]...
- Валентність атомів – Здатність атомів утворювати сполуки ХІМІЧНИЙ ЗВ’ ЯЗОК 1.2 . Валентність атомів Якщо один атом з’єднується з іншим атомом, то залежно від виду атомів утворюються іони або молекули. – При утворенні іонного зв’язку валентні електрони приймаються або віддаються повністю. – При утворенні молекул валентні електрони йдуть на утворення спільних електронних пар. Число хімічних зв’язків за рахунок отриманих або відданих електронів, […]...
- Будова електронних оболонок та властивості хімічних елементів Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ БУДОВА АТОМА Будова електронних оболонок та властивості хімічних елементів Металічні й неметалічні елементи Хімічні властивості елементів обумовлюються не всіма електронами, а тільки тими, які мають найбільшу енергію. Ці електрони називають валентними. В атомах елементів головних підгруп валентними е електрони зовнішнього енергетичного рівня. Завершені […]...
- Досягнення моделі Бора – Модель атома Бора БУДОВА АТОМА 4. Модель атома Бора Поштовхом для подальшого розвитку моделі атома Нільсоном Бором став відкритий у 1885 році Дж. Бальмером факт, що довжини хвиль усіх ліній видимого спектра газоподібного водню можна обчислити простою математичною формулою: λ – довжина хвилі лінії спектра; RН – стала Рідберга; N – порядкове число (n > 2). N λ/нм […]...
- МОДЕЛЬ ВІДШТОВХУВАННЯ ВАЛЕНТНИХ ЕЛЕКТРОННИХ ПАР ЦЕНТРАЛЬНОГО АТОМА – ПРОСТОРОВА КОНФІГУРАЦІЯ МОЛЕКУЛ Хімія – універсальний довідник БУДОВА РЕЧОВИНИ ПРОСТОРОВА КОНФІГУРАЦІЯ МОЛЕКУЛ МОДЕЛЬ ВІДШТОВХУВАННЯ ВАЛЕНТНИХ ЕЛЕКТРОННИХ ПАР ЦЕНТРАЛЬНОГО АТОМА Просторова конфігурація молекули визначається відштовхуванням електронних пар центрального атома: Просторове розташування чотирьох електронних пар умовно відповідає знаходженню їх у вершинах тетраедра (рис.9). Рис. 9. Міжелектронне відштовхування і структура молекул СН4, NН3, Н20. Тетраедричну конфігурацію має також іон амонію NH4+: […]...
- Ядерна модель (модель Резерфорда) БУДОВА АТОМА 3. Ядерна модель (модель Резерфорда) При опроміненні найтоншої золотої фольги α-частинками більшість частинок проходить через фольгу по прямій лінії, деякі з них відхиляються на різні кути, а приблизно 1 частинка зі 100 000 відбивається назад. Результати цього експерименту з розсіювання α-частинок, проведеного в 1911 році, неможливо пояснити моделлю Томсона. Ядерна модель Резерфорда заперечує […]...
- Поняття про радіус атома – Періодичний закон та теорія будови атома Хімія Загальна хімія Періодичний закон та теорія будови атома Поняття про радіус атома Атоми не мають чітко визначених меж, що зумовлено хвильовою природою електронів. У розрахунках користуються ефективними Й уявними радіусамИ, тобто радіусами шароподібних атомів, зближених між собою під час утворення кристала. Їх розраховують за допомогою рентгенометричних даних. Чим більший атомний радіус, тим слабкіше утримуються […]...
- Гібридизація електронних орбіталей ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 3. Хімічний зв’язок 3.4. Гібридизація електронних орбіталей Під час утворення молекул з ковалентним полярним зв’язком у деяких атомів відбувається характерне явище, яке називають гібридизацією електронних орбіталей – перетворення електронних орбіталей різного виду (s, р)1 на однакові за формою та енергією гібридні орбіталі. Sp3-гібридизація […]...
- Зображення орбіталей БУДОВА АТОМА 6 . Хвильова модель 6.2 . Зображення орбіталей Щоб наочно показати конфігурацію електронів атома, Л. Паулі запропонував зображувати його орбіталі у вигляді електронних комірок. Електрони в них зображають вертикальними стрілками. Для розпізнавання спінового квантового числа стрілки направлені у протилежних напрямах. Запам’ятайте: два електрони з протилежним спіном, які знаходяться на одній і тій самій […]...
- Електронна будова атомів металічних елементів – Загальні відомості про металічні елементи та метали ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.1. Загальні відомості про металічні елементи та метали Металічних елементів більше, ніж неметалічних: зі 118 відомих на початок 2012 р. елементів понад 90 – металічні. Усі металічні елементи утворюють прості речовини – метали. 8.1.1. Електронна будова […]...
- БУДОВА АТОМІВ ГАЛОГЕНІВ Хімія – універсальний довідник ГАЛОГЕНИ Галогенами називаються хімічні елементи VІІА групи. Ця загальна назва походить від грец. “галс” – сіль і “генес” – той, що народжує, тобто “солероди”. У галогенів яскравіше порівняно з іншими елементами виражені властивості неметалів. Кажуть, галогени – типові неметали. БУДОВА АТОМІВ ГАЛОГЕНІВ З галогенів у періодичній системі елементів першим розташований Флуор […]...
- Електронегативність – Періодичний закон та теорія будови атома Хімія Загальна хімія Періодичний закон та теорія будови атома Електронегативність Електронегативність – здатність атома притягати до себе електрони інших атомів (маються на увазі валентні електрони зовнішнього енергетичного рівня). Звичайно за одиницю приймають електронегативність Літію і з нею порівнюють електронегативність інших елементів, одержуючи прості й зручні для порівняння значення відносної електронегативності елементіВ. Відносна електронегативність відповідає Періодичному […]...
- Модель Томсона БУДОВА АТОМА 2. Модель Томсона Досліди Майкла Фарадея з електролізу в 1833 році та відкриття електрона Дж. Дж. Стоні в 1881 році вже неможливо було пояснити простою моделлю Дальтона. Дж. Дж. Томсон у 1904 році запропонував модель атома, що включала поняття заряду. – Атом складається з кулі, що має позитивний електричний заряд, в якій розміщені […]...
- ЕЛЕКТРОННА БУДОВА І ВЛАСТИВОСТІ АТОМІВ ХІМІЧНИХ ЕЛЕМЕНТІВ 3-ого ПЕРІОДУ Хімія – універсальний довідник ВІД НАТРІЮ ДО АРГОНУ ЕЛЕКТРОННА БУДОВА І ВЛАСТИВОСТІ АТОМІВ ХІМІЧНИХ ЕЛЕМЕНТІВ 3-ого ПЕРІОДУ Електронна будова атомів елементів 3-ого періоду визначається розподілом електронів на трьох енергетичних рівнях. При цьому перші два рівні, найближчі до ядра, заповнені цілком; їх будова описується електронною формулою 1s22s22р6. У періоді зліва направо відбувається поступове заповнення електронами зовнішнього, […]...
- Сучасна модель стану електрона в атомі ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 2. ПЕРІОДИЧНИЙ ЗАКОН Д. І. МЕНДЕЛЄЄВА І БУДОВА АТОМІВ § 2.5. Сучасна модель стану електрона в атомі Під час хімічних реакцій ядро атома не змінюється. Змін зазнають електронні оболонки атомів, будовою яких пояснюється багато властивостей хімічних елементів. Тому стану електронів в […]...
- Структура періодичної системи у світлі теорії будови атома Тема 3 ПЕРІОДИЧНИЙ ЗАКОН І ПЕРІОДИЧНА СИСТЕМА ХІМІЧНИХ ЕЛЕМЕНТІВ Д. І. МЕНДЕЛЄЄВА. БУДОВА АТОМА УРОК 49 Тема. Структура періодичної системи у світлі теорії будови атома Цілі уроку: розширити знання учнів про періодичну систему хімічних елементів; на підставі знань про будову атома й будови електронних оболонок атомів показати взаємозв’язок між розміщенням хімічних елементів у періодичній системі […]...
- Електронегативність – Здатність атомів утворювати сполуки ХІМІЧНИЙ ЗВ’ ЯЗОК 1.3. Електронегативність Енергія іонізації показує, наскільки легко атом втрачає електрон. Спорідненість до електрона визначає здатність нейтрального атома приймати електрон. Електронегативність (ЕН) визначає розподіл електронів в існуючому хімічному зв’язку. Вона є мірою здатності атома залучати валентні електрони до спільного зв’язку. Для оцінки ступеня електронегативності була створена відносна шкала від 1,0 для Літію до […]...
- Елементи головних і побічних підгруп – Періодична система елементів і хвильова модель БУДОВА АТОМА 6 . Хвильова модель 6.3 . Періодична система елементів І хвильова модель Порядок розташування елементів у періодичній системі можна пояснити на основі принципу заповнення орбіталей. Електронну конфігурацію будь-якого елемента можна вивести, виходячи із трьох принципів, що знаходяться в тісному зв’язку з урахуванням квантових чисел. – Рівні з меншою енергією заповнюються в першу чергу […]...
- Теорія будови атома – Періодичний закон та теорія будови атома Хімія Загальна хімія Періодичний закон та теорія будови атома Теорія будови атома Атом – це електронейтральна частинка, що складається з позитивно зарядженого ядра і негативно заряджених електронів. Будова атомних ядер Ядра атомів Складаються з елементарних частинок двох видів: протонів (p) і нейтронів (n). Сума протонів і нейтронів у ядрі одного атома називається нуклонним числом: , […]...
- Валентність атомів елементів. Визначення валентності й складання хімічних формул за валентністю атомів елементів Хімія Загальна хімія Основні поняття, закони й теорії хімії Валентність атомів елементів. Визначення валентності й складання хімічних формул за валентністю атомів елементів Валентність – це властивість атомів хімічного елемента утворювати хімічні зв’язки з певним числом атомів інших хімічних елементів. За одиницю валентності прийнята валентність атома Гідрогену. Він одновалентний, тобто може утворювати тільки один зв’язок. Кількісне […]...
- БУДОВА АТОМІВ ЛУЖНИХ МЕТАЛІВ – ЛУЖНІ МЕТАЛИ Хімія – універсальний довідник ЛУЖНІ МЕТАЛИ Лужними металами називаються елементи ІА групи. Якщо галогени є типовими, найяскравіше вираженими неметалами, то елементи ІА групи – це типові метали. БУДОВА АТОМІВ ЛУЖНИХ МЕТАЛІВ З елемента ІА групи розпочинається кожен період у таблиці Д. І. Менделєєва. Це означає, що саме в атомах цих елементів розпочинається заповнення наступного енергетичного […]...
- Складання формул сполук за відомим ступенем окиснення атомів елементів Тема 4 ХІМІЧНИЙ ЗВ’ЯЗОК І БУДОВА РЕЧОВИНИ УРОК 63 Тема. Складання формул сполук за відомим ступенем окиснення атомів елементів Цілі уроку: закріпити навички складання хімічних формул за відомими ступенями окиснення атомів, визначення ступенів окиснення; розширити уявлення про хімічні реакції на прикладі хімічних реакцій зі зміною ступеня окиснення атомів; показати єдність двох процесів – окиснення й […]...
- Положення елементів-металів у періодичній системі, особливості будови атомів. Металічний зв’язок. Фізичні властивості металів ІІ семестр Тема 2. МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ (13 годин) УРОК 23 Тема уроку. Положення елементів-металів у періодичній системі, особливості будови атомів. Металічний зв’язок. Фізичні властивості металів Цілі уроку: поглибити знання учнів про металеві елементи, їх положення в періодичній системі, особливості будови атомів, будови речовини; ознайомити з типом хімічного зв’язку, властивим металам, – металічним […]...
- Значення періодичного закону і теорії будови атомів ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 2. ПЕРІОДИЧНИЙ ЗАКОН Д. І. МЕНДЕЛЄЄВА І БУДОВА АТОМІВ § 2.11 Значення періодичного закону і теорії будови атомів Періодичний закон Д. І. Менделєєва має винятково важливе значення. Він започаткував сучасну хімію, зробив її єдиною, цілісною наукою. Елементи почали розглядати у взаємозв’язку, […]...