Електронна будова атомів металічних елементів – Загальні відомості про металічні елементи та метали
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ
8. Металічні елементи та їхні сполуки. Метали
8.1. Загальні відомості про металічні елементи та метали
Металічних елементів більше, ніж неметалічних: зі 118 відомих на початок 2012 р. елементів понад 90 – металічні. Усі металічні елементи утворюють прості речовини – метали.
8.1.1. Електронна будова атомів металічних елементів
Атоми металічних елементів мають у зовнішньому енергетичному рівні невелику кількість електронів
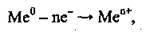
Де n – кількість електронів, які віддає атом металічного елемента.
Розгляньмо електронну будову атома Калію: 19К 1s22s22p63s22p64s1. На останньому, четвертому, енергетичному рівні в атомі Калію міститься один електрон (4s1), а на передостанньому – октет електронів
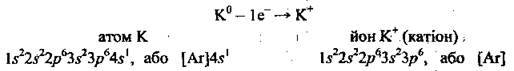
Розгляньмо будову атома Магнію: 12Mg 1s22s22p63s2.
На останньому, третьому, енергетичному рівні атома є два електрони (3s2), а на передостанньому – октет електронів (2s22p6). Атом Магнію легко віддає два електрони. Частинка, що утворюється (йон), отримує заряд +2. Заряд ядра атома Магнію залишився незмінним (+12), а електронів стало на два менше (10). Сумарний заряд дорівнює +2. Таким чином електронейтральний атом Магнію перетворюється на позитивно заряджений йон – катіон Магнію:
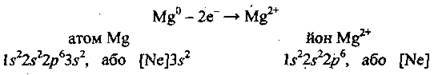
Зрозуміло, що кожний катіон містить менше електронів, ніж протонів. У катіонів, порівняно з електронейтральними атомами, зменшується кількість енергетичних рівнів: їх стає на один менше. Таким чином, радіуси катіонів менші, ніж радіуси відповідних атомів: 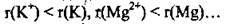
Здатність атомів металічних елементів втрачати електрони зростає зі збільшенням радіусів атомів: у періоді – справа наліво, а в групі – згори донизу (для елементів головних підгруп). Так, найтиповіші металічні елементи розміщуються внизу IА групи. Це, зокрема, Цезій, Рубідій.
Атоми металічних елементів виявляють зазвичай лише позитивні ступені окиснення. Для s – і р-елементів вони сталі, а в d-елементів – можуть бути різними (оскільки в них валентними є не лише s-, а й d-електрони). Це відбивається і на зміні металічних властивостей: у побічних групах зі збільшенням порядкового номера елемента металічні властивості d-елементів послаблюються.
Прості катіони, які утворюють металічні елементи головних підгруп I-III груп, входять до складу відповідних оксидів, основ, солей.
Значення зарядів таких йонів для елементів головних підгруп I-III груп збігається з номером груп.
Так, металічні елементи групи ІА утворюють прості катіони Ме+ (К+, Na+, Li4), групи ІІА – Ме2+ (Са2+, Ва2+, Mg2+), групи ІIIА – Ме3+ (Аl3+).
Однак ця закономірність не стосується елементів побічних підгруп. Так, d-елемент І групи Купрум утворює два прості катіони – Сu+ і Сu2+, а Ферум (VIIIB)-Fe2+ і Fe3+.