Гідроліз солей як окремий випадок реакцій йонного обміну у водних розчинах електролітів
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ
6. Суміші речовин. Розчини
6.11. Гідроліз солей як окремий випадок реакцій йонного обміну у водних розчинах електролітів
У хімії часто стикаються з явищем гідролізу1 – хімічної взаємодії речовин з водою. Найбільше практичне значення має гідроліз солей.
Гідроліз солей – це хімічна взаємодія солей з водою, у результаті якої утворюється слабкий електроліт.
Сутність гідролізу вводиться до хімічної взаємодії катіонів і аніонів
За здатністю розкладатися молекулами води, йони солей класифікують таким чином:
– катіони, що походять від слабких основ, для яких характерні в основному заряди 2+ і 3+ (Cu2+, Fe2+, Fe3+, Zn2+, Al3+, Sn2+, Cd2+). Реакції таких катіонів з водою називають гідролізом за катіоном;
– аніони, які походять від слабких кислот: NO2-, CO32-, SO32-, МnО42-, МnО4-, Сr2O72-, СrO42-. Реакції таких аніонів з водою називають гідролізом за аніоном. Отже, за природою своїх йонів
1 | Солі, які складаються з катіонів слабких основ і аніонів сильних кислот. Вони гідролізують за катіоном, реакції гідролізу є оборотними | ZnSO4, CuCl2, Fe(NO3)3, СrВr3, Al2(SO4)3, NHtBr, Mn(NO3)2, Pb(NO3)2 |
2 | Солі, які складаються з катіонів сильних основ і аніонів слабких кислот. Вони гідролізують за аніоном, реакції гідролізу є оборотними | Na2S, K2CO3, Li2SO3, NaF, NaCN, CH3COOK, Ba(NO2)2 |
3 | Солі, які складаються з катіонів слабких основ і аніонів слабких кислот, гідролізують як за катіоном, так і за аніоном. Практично ці реакції гідролізу є необоротними. Кількість солей цього типу, здатних до гідролізу, обмежена | NH4NO2, AlF3, CH3COONH4, (NH4)2S, Pb(NO2)2, NH4CN |
4 | Солі, утворені аніонами сильних кислот і катіонами сильних основ, гідролізу не піддаються | NaCl, K2SO4, Ca(NO3)2, KBr, BaI2 |
Розгляньмо приклади гідролізу різних солей.
1. Гідроліз солей, утворених катіонами слабкої основи й аніонами сильної кислоти.
Приклад 1. Гідроліз амоній нітрату:
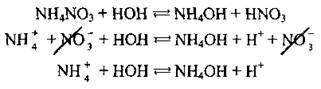
При розчиненні у воді солі амоній нітрату катіони амонію NH4+ зв’язуються з гідроксид-іонами ОН – води, утворюючи слабкий електроліт – амоній гідроксид. У розчині з’являється надлишок йонів Н+. Середовище розчину стає кислим, pH < 7.
Приклад 2. Гідроліз купрум(ІІ) хлориду. Гідроліз солі СuСl2 відбувається по катіону, оскільки сіль утворена слабкою основою Сu(ОН)2. Це двокислотна основа, а тому гідроліз може відбуватися за двома ступенями:
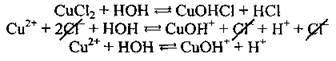
Продуктами гідролізу за першим ступенем є основна сіль CuOHCl (слабкий електроліт) і сильна кислота НСl. Багатозарядні катіони (Ме2+, Ме3+) гідролізують переважно за першим ступенем.
2. Гідроліз солей, утворених сильною основою і слабкою кислотою.
Приклад 1. Гідроліз натрій карбонату:
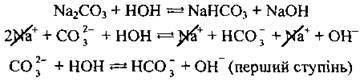
При розчиненні у воді натрій карбонату карбонат-іони зв’язуються з йонами Н+, утворюючи слабкий електроліт НСО3-, і в розчині з’являється надлишок гідроксид-іонів ОН-. Середовище розчину стає лужним, pH > 7.
Гідроліз за другим ступенем майже не здійснюється, оскільки вже на першому ступені гідролізу утворюється слабша кислота НСО3- порівняно з Na2CO3, що утворюється за другим ступенем:
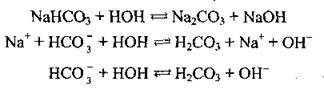
Приклад 2. Гідроліз натрій сульфіду:
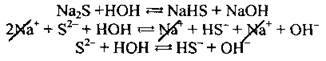
3. Гідроліз солей, утворених слабкими основами і слабкими кислотами. Такі реакції є практично необоротними, оскільки під час їхнього проходження утворюються два слабкі електроліти (малодисоційовані або важкорозчинні).
Приклад 1. Гідроліз амоній нітрату:
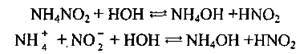
Приклад 2. Гідроліз амоній ацетату:
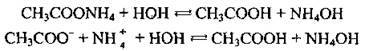
Обидва йони (і катіон, і аніон) беруть участь у реакції гідролізу. Якщо константи дисоціації основи і кислоти, які утворилися, за значенням близькі, то реакція розчину практично залишається нейтральною; якщо ж вони різняться на кілька порядків, то середовище може бути слабокислим або слабо лужним – залежно від сили кислоти й основи. Слід пам’ятати, що розчини деяких солей (у таблиці розчинності вони позначені рисками) отримати неможливо. Зазвичай у воді вони повністю (або майже повністю) гідролізують.
Процесом гідролізу солей можна керувати:
1. Щоб запобігти гідролізу або загальмувати його, змістивши рівновагу ліворуч, до розчину потрібно додати одну з тих речовин, які утворюються. Якщо утворюється кислота, додають НСl; якщо ж луг, то КОН.
2. Щоб пришвидшити гідроліз, у розчин, де утворюється кислота, додають луг. І навпаки, додають кислоту в розчин, де утворюється луг.
3. Якщо розбавляти розчин, то підвищується концентрація води і, згідно із законом діючих мас, відбувається зміщення рівноваги праворуч. Це означає, що гідроліз пройде повніше.
4. Ступінь дисоціації води при підвищенні температури дуже зростає, тобто підвищується концентрація йонів Н+ і ОН-, що збільшує ймовірність утворення малодисоційованих молекул кислоти чи основи. Отже, гідроліз відбувається повніше.
Отже, якщо необхідно уповільнити гідроліз, то потрібно працювати з концентрованими розчинами на холоді (корисно також додати надлишок одного з продуктів, що утворюються – лугу чи кислоти).
________________________________________________________
1 Слово гідроліз у перекладі з грецької означає “розклад водою”.
