Йонний зв’язок – Йонний, металічний і водневий зв’язки
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ
3. Хімічний зв’язок
3.7. Йонний, металічний і водневий зв’язки
3.7.1. Йонний зв’язок
Якщо різниця електронегативностей пари атомів, що утворюють зв’язок, > 1,7 (за Полінгом), між ними утворюється йонний зв’язок. Зазвичай йонний зв’язок утворюється між металічними і неметалічними елементами. Атоми металічних елементів віддають електрони і перетворюються на позитивно заряджені йони – катіони. Атоми неметалічних
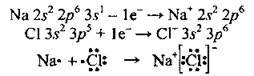
Окремі йонні молекули можуть існувати лише за дуже високої температури (у газоподібному стані), За звичайних умов такі сполуки – тверді кристалічні речовини. Так, кристал NaCl – натрій хлориду – це сполучення великої кількості йонів Na+ і йонів Сl-. Причому кожний йон Na+ оточений шістьма йонами Сl – і навпаки.
Related posts:
- Металічний зв’язок – Йонний, металічний і водневий зв’язки ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 3. Хімічний зв’язок 3.7. Йонний, металічний і водневий зв’язки 3.7.2. Металічний зв’язок У речовинах, які утворені металічними хімічними елементами, між атомами виникає металічний зв’язок. Як відомо, атоми металів відносно легко віддають валентні електрони, внаслідок чого утворюються позитивно заряджені йони. Такий процес відбувається не […]...
- Водневий зв’язок – Йонний, металічний і водневий зв’язки ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 3. Хімічний зв’язок 3.7. Йонний, металічний і водневий зв’язки 3.7.3. Водневий зв’язок Низка сполук з полярним Ковалейтним зв’язком, які містять Гідроген і елемент з високою електронегативністю (найчастіше Оксиген, Флуор, Нітроген), утворюють так званий водневий зв’язок (позначають “—“). Це різновид невалентного міжмолекулярного зв’язку (вандерваальсового1), […]...
- Йонний зв’язок Хімія Загальна хімія Хімічний зв’язок Йонний зв’язок Йонний зв’язок – це зв’язок, зумовлений електростатичним тяжінням між різнойменно зарядженими йонами. Під час утворення йонного зв’язку один з атомів віддає електрон, перетворюючись на позитивно заряджений іон – катіоН, а інший приймає електрон, перетворюючись на негативно заряджений іон – аніоН. Різниця між електронегативностями атомів, які утворюють йонний зв’язок, […]...
- Металічний зв’язок Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ХІМІЧНИЙ ЗВ’ЯЗОК І БУДОВА РЕЧОВИНИ Металічний зв’язок Метали мають низку спільних фізичних властивостей: – добру електропровідність; – добру теплопровідність; – металічний блиск; – добру пластичність (ковкість); – зазвичай високу твердість; – як правило, перебувають у твердому агрегатному стані. Такі спільні фізичні властивості металів […]...
- Кристалічні гратки Хімія Загальна хімія Хімічний зв’язок Кристалічні гратки Залежно від фізичних умов речовини можуть існувати в різних агрегатних станаХ: – Плазма – іонізований газ; – Газоподібний стаН, який характеризується слабкою і невпорядкованою взаємодією частинок (молекул); – Рідкий стаН, за якого взаємодія між частинками сильніша, ніж у газах, у розташуванні частинок існує певний порядок, але він постійно […]...
- Стійкість електронних шарів. Перетворення атомів на йони – Електрон. Електронні шари ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 2. Будова атома 2.4. Електрон. Електронні шари 2.4.3. Стійкість електронних шарів. Перетворення атомів на йони Найстійкішою електронною конфігурацією атома є така, при якій у зовнішньому електронному шарі розміщується 2 (як р атома Гелію) або 8 е – (як в атомах інших інертних газів). […]...
- Металічний зв’язок – Типи хімічного зв’язку ХІМІЧНИЙ ЗВ’ ЯЗОК 2. Типи хімічного зв’язку 2.2. Металічний зв’язок Слабо електронегативні атоми металів мають велику здатність віддавати електрони і ставати позитивними іонами. Тому вони формують металічні гратки без участі негативних іонів. Валентні електрони, віддані атомами металу, оточують позитивно заряджені іони металу й утримують гратку електростатичними силами. Запам’ятайте: у металічному зв’язку, на відміну від інших […]...
- Елементи-метали в Періодичній системі – Метали Хімія Неорганічна хімія Метали Елементи-метали в Періодичній системі Якщо в Періодичній системі провести діагональ від Берилію до Астату, то зліва внизу розміщуватимуться елементи-метали (до них же належать елементи побічних підгруп). Атоми металів порівняно легко віддають електрони, перетворюючись на позитивно заряджені йони. Це пояснюється тим, що в атомів металів: – мале число електронів на зовнішньому енергетичному […]...
- Зміна ступеню окиснення – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція 4.5. Зміна ступеню окиснення Процес віддачі електронів атомом, молекулою або йоном називають окисненням. Атоми, молекули або йони, що віддають електрони, називають відновниками. Під час реакцій вони окислюються: Процес приєднання електронів атомом, молекулою або йоном називають відновленням. Атоми, молекули або йони, […]...
- Іонний зв’язок Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ХІМІЧНИЙ ЗВ’ЯЗОК І БУДОВА РЕЧОВИНИ Іонний зв’язок Утворення іонного зв’язку Іонний зв’язок за механізмом утворення нагадує ковалентний, але має принципову відмінність: у речовинах з іонним зв’язком атоми жорстко не з’єднуються один з одним, а просто притягуються електростатичними взаємодіями. Атоми лужних металів, наприклад Натрію, […]...
- СТІК ЙОННИЙ Екологія – охорона природи СТІК ЙОННИЙ – кількість мін. розчинених речовин, що проносяться річковим потоком через його переріз за певний проміжок часу....
- Модель Томсона БУДОВА АТОМА 2. Модель Томсона Досліди Майкла Фарадея з електролізу в 1833 році та відкриття електрона Дж. Дж. Стоні в 1881 році вже неможливо було пояснити простою моделлю Дальтона. Дж. Дж. Томсон у 1904 році запропонував модель атома, що включала поняття заряду. – Атом складається з кулі, що має позитивний електричний заряд, в якій розміщені […]...
- ЕЛЕКТРОНИ Хімія – універсальний довідник БУДОВА АТОМА ЕЛЕКТРОНИ Усі речовини електронейтральні. Атоми, як складові частини речовини, також повинні бути нейтральними. Крім позитивно зарядженого ядра, до складу атома входять негативно заряджені частинки – електрони. Електричний заряд електрона (негативний) чисельно дорівнює заряду протона (позитивному), тому зрозуміло, що в нейтральному атомі число електронів дорівнює числу протонів у його ядрі. […]...
- Положення елементів-металів у періодичній системі, особливості будови атомів. Металічний зв’язок. Фізичні властивості металів ІІ семестр Тема 2. МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ (13 годин) УРОК 23 Тема уроку. Положення елементів-металів у періодичній системі, особливості будови атомів. Металічний зв’язок. Фізичні властивості металів Цілі уроку: поглибити знання учнів про металеві елементи, їх положення в періодичній системі, особливості будови атомів, будови речовини; ознайомити з типом хімічного зв’язку, властивим металам, – металічним […]...
- ВЗАЄМОДІЯ ГАЛОГЕНІВ З МЕТАЛАМИ Хімія – універсальний довідник ГАЛОГЕНИ ВЗАЄМОДІЯ ГАЛОГЕНІВ З МЕТАЛАМИ Хімічні властивості галогенів, тобто здатність вступати в реакції, утворювати ті або інші сполуки, визначаються їхнім місцем у періодичній системі. Кожен галоген практично завершує період, у якому він знаходиться. Розглянемо спочатку утворення сполуки одного з галогенів, а саме – Хлору з Натрієм. Електронна формула атома Натрію Він […]...
- Водневий зв’язок Хімія Загальна хімія Хімічний зв’язок Водневий зв’язок Водневий зв’язок – це зв’язок між позитивно зарядженим атомом Гідрогену однієї молекули і негативно зарядженим атомом іншої молекули. Водневий зв’язок має частково електростатичний, частково донорно-акцепторний характер....
- Тести – Урок 3 ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 3. Хімічний зв’язок Тести 3.1 Укажіть тип хімічного зв’язку в речовині, формула якої NaF А йонний Б ковалентний неполярний В ковалентний полярний Г металічний 3.2 Укажіть формулу речовини з полярним ковалентним зв’язком А КВr Б KF B N2 Г Н2O 3.3 Укажіть тип […]...
- ПРЕДМЕТ ОРГАНІЧНОЇ ХІМІЇ – ОРГАНІЧНІ СПОЛУКИ Хімія – універсальний довідник ОРГАНІЧНІ СПОЛУКИ ПРЕДМЕТ ОРГАНІЧНОЇ ХІМІЇ Органічна хімія – це хімія вуглеводнів і їх похідних. Вуглеводні – це, як випливає уже з назви, сполуки Карбону з Гідрогеном. Найпростішою з них є метан СН4. “Похідними” вуглеводнів називають речовини, які можна з них “зробити” (іноді лише думкою) шляхом заміни атомів Гідрогену на інші атоми […]...
- Умови виникнення хімічного зв’язку Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ХІМІЧНИЙ ЗВ’ЯЗОК І БУДОВА РЕЧОВИНИ Умови виникнення хімічного зв’язку Хімічний зв’язок – це взаємодія атомів, здійснювана шляхом обміну електронами або їхнім переходом від одного атома до іншого. Не всі атоми можуть взаємодіяти між собою. Буває так, що при зближенні атомів та перекриванні їхніх […]...
- Хлориди ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.2. Галогени 9.2.3. Хлориди Усі металічні елементи утворюють солі хлоридної кислоти – хлориди. Більшість з них є розчинними у воді. Незначну розчинність має плюмбум(ІІ) хлорид. Практично не розчиняється у воді, а також у кислотах аргентум хлорид […]...
- Водневий показник розчинів солей – Протолітична рівновага КИСЛОТИ Й ОСНОВИ 2. Протолітична рівновага 2.4. Водневий показник розчинів солей Багато сольових розчинів мають нейтральне середовище, деякі – кисле або лужне. За Бренстедом, вода при цьому виконує функцію основи або кислоти. Приклад. Натрій хлорид Іон Na+: не вступає в реакцію з водою. Іон Сl-: надзвичайно слабка основа, тому протоліз не відбувається. Розчин натрій хлориду […]...
- Водневий зв’язок – Типи хімічного зв’язку ХІМІЧНИЙ ЗВ’ ЯЗОК 2. Типи хімічного зв’язку 2.4 . Водневий зв’язок У молекулах атоми Гідрогену крім електронної пари не мають інших електронів. Ядро атома Гідрогену (протон) дуже мале, тому густина позитивного заряду дуже велика. Якщо атоми Гідрогену утворюють молекули з найбільш електронегативними атомами, то зв’язуюча електронна пара значно відтягнута від протонів. Тому на зовнішнє оточення […]...
- Дисоціація води. Водневий показник ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини 6.8. Дисоціація води. Водневий показник Хімічно чиста вода дуже слабо проводить електричний струм. Провідність зумовлена дисоціацією: За температури 25 °С ступінь дисоціації води а = 1,8 · 10-9. Оскільки 1 л води (1000 г) містить 55,56 моль речовини, концентрації […]...
- Електронна будова атомів металічних елементів – Загальні відомості про металічні елементи та метали ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.1. Загальні відомості про металічні елементи та метали Металічних елементів більше, ніж неметалічних: зі 118 відомих на початок 2012 р. елементів понад 90 – металічні. Усі металічні елементи утворюють прості речовини – метали. 8.1.1. Електронна будова […]...
- Атоми. Молекули. Йони Контрольні запитання № 1. Речовини складаються з атомів, молекул, йонів. № 2. Атоми – це найдрібніші електронейтральні частинки речовини, які складаються з позитивно зарядженого ядра й негативно заряджених електронів, що рухаються навколо ядра. Молекули – це найдрібніші частинки речовини, що здатні існувати самостійно і є носіями властивостей речовин. Йони – це одноатомні або багатоатомні частинки, […]...
- ВАЛЕНТНІСТЬ І ЕЛЕКТРОННА БУДОВА АТОМІВ Хімія – універсальний довідник ВІД НАТРІЮ ДО АРГОНУ ВАЛЕНТНІСТЬ І ЕЛЕКТРОННА БУДОВА АТОМІВ Для схематичного зображення електронної будови атомів часто використовується наступна форма: записують символ елемента і навколо нього крапками позначають електрони зовнішнього валентного рівня. Для елементів 3-го періоду такий запис матиме вигляд: Розглянемо валентності, які можуть проявляти атоми цих елементів. Як зазначалося вище, за […]...
- ІОННИЙ І КОВАЛЕНТНИЙ ЗВ’ЯЗОК Хімія – універсальний довідник ВІД НАТРІЮ ДО АРГОНУ ІОННИЙ І КОВАЛЕНТНИЙ ЗВ’ЯЗОК Атоми того самого елемента притягують до себе електрони однаково, тому електрони на зв’язучій молекулярній орбіталі між однаковими атомами (у простих речовинах), можна сказати, однаковою мірою належать обом атомам. У цьому випадку кажуть про ковалентний зв’язок. Різні атоми притягують електрони з різною силою, тому […]...
- Іонний зв’язок – Типи хімічного зв’язку ХІМІЧНИЙ ЗВ’ ЯЗОК 2. Типи хімічного зв’язку При утворенні хімічного зв’язку атоми, що беруть участь у ньому, намагаються набути конфігурації інертного газу. Оскільки при цьому задіяні лише оболонки валентних електронів, то для зображення атома використовують так звану формулу Льюїса, в якій зображені лише валентні електрони. Приклад. Зображення електронної будови атома Натрію і атома Хлору та […]...
- ЗАГАЛЬНА ХАРАКТЕРИСТИКА МЕТАЛІЧНИХ ЕЛЕМЕНТІВ ЗА ЇХ ПОЛОЖЕННЯМ У ПЕРІОДИЧНІЙ СИСТЕМІ Й БУДОВОЮ АТОМІВ. МЕТАЛИ ЯК ПРОСТІ РЕЧОВИНИ. МЕТАЛІЧНИЙ ЗВ’ЯЗОК, МЕТАЛІЧНІ КРИСТАЛІЧНІ ГРАТКИ ТЕМА 2. МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ УРОК 1. ЗАГАЛЬНА ХАРАКТЕРИСТИКА МЕТАЛІЧНИХ ЕЛЕМЕНТІВ ЗА ЇХ ПОЛОЖЕННЯМ У ПЕРІОДИЧНІЙ СИСТЕМІ Й БУДОВОЮ АТОМІВ. МЕТАЛИ ЯК ПРОСТІ РЕЧОВИНИ. МЕТАЛІЧНИЙ ЗВ’ЯЗОК, МЕТАЛІЧНІ КРИСТАЛІЧНІ ГРАТКИ Цілі: на основі знань про періодичну систему елементів і будову атома дати загальну характеристику металічних елементів за їх положенням у періодичній системі й будовою […]...
- Основні положення теорії електролітичної дисоціації – Електролітична дисоціація ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини 6.6. Електролітична дисоціація 6.6.2. Основні положення теорії електролітичної дисоціації 1. Електроліти під час розчинення у воді розпадаються (дисоціюють) на йони. У розчинах чи розплавах електролітів йони рухаються хаотично. 2. Під дією електричного поля (різниці потенціалів) рух йонів набуває спрямованості: […]...