Кальцій гідроксид – Металічні елементи головної підгрупи II групи
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ
8. Металічні елементи та їхні сполуки. Метали
8.3. Металічні елементи головної підгрупи II групи1
8.3.7. Кальцій гідроксид
Кальцій гідроксид (Са(ОН)2). Насичений водний розчин кальцій гідроксиду називають вапняною водою, а білу суспензію кальцій гідроксиду – вапняним молоком.
Одержання кальцій гідроксиду У лабораторії Са(ОН)2 одержують при взаємодії кальцію чи його оксиду з водою:
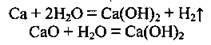
У промисловості
Хімічні властивості кальцій гідроксиду
Кальцій гідроксид – луг. Дисоціює двоступенево. Взаємодіє:
– з кислотними оксидами:
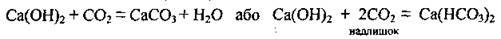
– з кислотами, утворюючи солі різних типів:
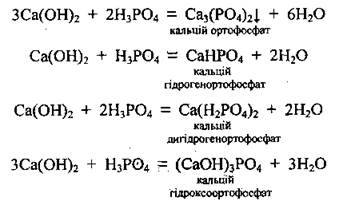
– з хлором (та іншими галогенами):
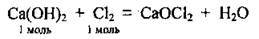
Або при надлишку хлору може утворитись суміш СаСl2 і Са(ОСl)2, яку називають хлорним вапном;
– із солями:
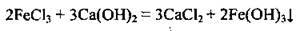
– з амфотерними оксидами і гідроксидами при сплавлянні:
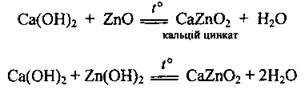
Related posts:
- Кальцій оксид – Металічні елементи головної підгрупи II групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.3. Металічні елементи головної підгрупи II групи1 8.3.6. Кальцій оксид Кальцій оксид СаО має технічні назви палене вапно, негашене вапно. Кальцій оксид – сполука з яскраво вираженими основними властивостями. Добування кальцій оксиду У лабораторії: А) окисненням […]...
- Магній гідроксид – Металічні елементи головної підгрупи II групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.3. Металічні елементи головної підгрупи II групи1 8.3.4. Магній гідроксид Магній гідроксид – нерозчинна у воді речовина білого кольору. При нагріванні розкладається: Взаємодіє: – з кислотними оксидами: – з кислотами (легко): – з амфотерними оксидами (при […]...
- Магній оксид – Металічні елементи головної підгрупи II групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.3. Металічні елементи головної підгрупи II групи1 8.3.3. Магній оксид Магній оксид MgO – основний оксид. З водою не реагує, взаємодіє: – з кислотними оксидами (при нагріванні): – з кислотами: – із солями, витісняючи менш активні […]...
- Кальцій – Металічні елементи головної підгрупи II групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.3. Металічні елементи головної підгрупи II групи1 8.3.5. Кальцій Кальцій – 20-й елемент періодичної таблиці, заряд ядра – +20. Хімічний символ – Са. Відносна атомна маса – 40. Утворює просту речовину – сріблясто-білий метал кальцій. Виявляє […]...
- Загальна характеристика – Урок 2 – Металічні елементи головної підгрупи II групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.3. Металічні елементи головної підгрупи II групи1 8.3.1. Загальна характеристика Лужноземельні металічні елементи – це s-елементи, які розміщуються у головній підгрупі II групи періодичної системи, а саме: Кальцій (Са), Стронцій (Sr), Барій (Ва), Радій (Ra). Інші […]...
- Солі кальцію – Металічні елементи головної підгрупи II групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.3. Металічні елементи головної підгрупи II групи1 8.3.8. Солі кальцію Якісне виявлення: іони Са2+ забарвлюють полум’я газового пальника в цегляно-червоний колір. Карбонат амонію осаджує з розчинів солей Кальцію білий осад СаСО3. Гіпс CaSО4 · 2Н2О при […]...
- Магній – Металічні елементи головної підгрупи II групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.3. Металічні елементи головної підгрупи II групи1 8.3.2. Магній Магній – 12-й елемент періодичної таблиці, заряд ядра – +12. Хімічний символ – Mg, відносна атомна маса – 24. Відомо три стабільні природні ізотопи Магнію: 24Mg (78,6 […]...
- Твердість води – Металічні елементи головної підгрупи II групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.3. Металічні елементи головної підгрупи II групи1 8.3.9. Твердість води Твердість води зумовлена наявністю розчинних у ній солей. При використанні твердої води витрачається значно більше мийних засобів, утворюється накип на посуді та нагрівальних приладах. Дуже м’яка […]...
- Оксиди і гідроксиди Натрію та Калію – Елементи головної підгрупи І групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.2. Елементи головної підгрупи І групи1 8.2.3. Оксиди і гідроксиди Натрію та Калію Оксиди Натрію та Калію – це тверді білі речовини, які виявляють основні властивості, реагуючи – з водою (утворюються луги): – з кислотами: – […]...
- Кальцій. Кальцій гідроксид і кальцій оксид – Метали Хімія Неорганічна хімія Метали Кальцій. Кальцій гідроксид і кальцій оксид Кальцій Кальцій Розташований у IIА групі (II групі, головній підгрупі), 4 періоді Періодичної системи. Він належить до лужноземельних металів. Електронна конфігурація атома Кальцію: На зовнішньому енергетичному рівні розміщені два електрони; ступінь окиснення Кальцію в сполуках +2. У вільному вигляді Кальцій у природі не зустрічається, поширений […]...
- Загальна характеристика – Елементи головної підгрупи І групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.2. Елементи головної підгрупи І групи1 8.2.1. Загальна характеристика Лужні металічні елементи – це s-елементи, які розміщуються у головній підгрупі І групи періодичної системи: Літій (Li), Натрій (Na), Калій (К), Рубідій (Rb), Цезій (Cs) та Францій […]...
- Калійні добрива – Елементи головної підгрупи І групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.2. Елементи головної підгрупи І групи1 8.2.4. Калійні добрива Грунт – це верхній природний шар земної кори, основною характеристикою якого є родючість. Вона визначається багатьма факторами, зокрема вологістю та наявністю біогенних елементів2 – Нітрогену (30-50 мг/кг), […]...
- Натрій і Калій – Елементи головної підгрупи І групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.2. Елементи головної підгрупи І групи1 8.2.2. Натрій і Калій Натрій – 11-й елемент періодичної таблиці, заряд ядра – +11. Хімічний символ – Na. Природний Натрій складається з одного стабільного ізотопу – 23Na; відомо також 6 […]...
- Нітратні добрива – Елементи VA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.4. Елементи VA групи 9.4.8. Нітратні добрива1 NaNO3 – натрієва (чилійська) селітра, KNO3 – калієва (індійська) селітра, Ca(NO3)2 – кальцієва (норвезька) селітра. Для добування кальцієвої селітри використовують реакції кальцій оксиду або кальцій гідроксиду з нітратною кислотою: […]...
- Кальцій. Кальцій оксид і гідроксид. Солі Кальцію. Поняття про твердість води. Використання найважливіших сполук Кальцію ІІ семестр Тема 2. МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ (13 годин) УРОК 29 Тема уроку. Кальцій. Кальцій оксид і гідроксид. Солі Кальцію. Поняття про твердість води. Використання найважливіших сполук Кальцію Цілі уроку: розширити знання учнів про метали на прикладі лужноземельних металів; вивчити властивості лужноземельних металів, їхніх сполук, способи одержання й застосування на прикладі Кальцію; продовжити […]...
- Фосфор(V) оксид – Елементи VA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.4. Елементи VA групи 9.4.10. Фосфор( V ) оксид Фосфор(V) оксид Р2O5 – твердий білий гігроскопічний (здатний вбирати вологу) порошок, сильний водо-поглинальний засіб; також може забирати воду навіть з хімічних сполук. Стійкий оксид, не виявляє окислювальних […]...
- Алюміній гідроксид – Алюміній ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.4. Алюміній 8.4.2. Алюміній гідроксид Алюміній гідроксид – це біла тверда речовина, яка не розчиняється у воді. Це амфотерна основа. Лише свіжоосаджений алюміній гідроксид розчиняється в лугах та кислотах: А в розчині утворюються комплексні солі: При […]...
- КАЛЬЦІЙ – ХІМІЯ МЕТАЛІЧНИХ ЕЛЕМЕНТІВ Хімія – універсальний довідник ХІМІЯ МЕТАЛІЧНИХ ЕЛЕМЕНТІВ КАЛЬЦІЙ Одна з найважливіших сполук кальцію – оксид СаО (негашене вапно). Його одержують розкладом вапняку (що складається, в основному, з карбонату кальцію) при високій (біля 1000 °С) температурі: Це – оксид лужноземельного металу, тому він легко взаємодіє з водою, утворюючи луг – гідроксид кальцію: Технічна назва Са(ОН)2 – […]...
- Карбонатна кислота – Елементи IV групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.5. Елементи IV Групи 9.5.4. Карбонатна кислота Карбонатна кислота Н2СO3 – слабка двохосновна кислота, існує в дуже розбавлених розчинах. Є слабким електролітом. Дисоціює двоступенево (II ступінь – у незначній мірі): Добування карбонатної кислоти Карбонатну кислоту одержують […]...
- Нітроген(IV) оксид – Елементи VA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.4. Елементи VA групи 9.4.5. Нітроген( IV ) оксид Нітроген утворює п’ять оксидів зі ступенями окиснення +1, +2, +3, +4 і +5. Нітроген(ІV) оксид, нітроген діоксид NO2 за стандартних умов – це газ бурого кольору1 з […]...
- Сплави на основі заліза (чавун, сталь) – Загальні відомості про металічні елементи та метали ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.1. Загальні відомості про металічні елементи та метали 8.1.6. Сплави на основі заліза (чавун, сталь) Чавун і сталь – це сплави на основі заліза. Цикл чорної металургії включає в себе: – чавунно-доменне виробництво1; – виробництво сталі […]...
- Оксиди Сульфуру – Елементи VIA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.3. Елементи VIA Групи 9.3.8. Оксиди Сульфуру Сульфур(ІV) оксид Сульфур утворює два оксиди – сульфур(ІV) оксид і сульфур(VІ) оксид. Найбільше значення серед сполук Сульфуру зі ступенем окиснення +4 має сульфур(ІV) оксид (сульфур діоксид, сірчистий газ) SO2. […]...
- Нітратна кислота – Елементи VA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.4. Елементи VA групи 9.4.6. Нітратна кислота Нітратна кислота HNO3 – одна з найважливіших неорганічних кислот. Зв’язки між атомами в молекулі кислоти полярні ковалентні. Нітроген у нітратній кислоті виявляє свою максимальну валентність – IV, а ступінь […]...
- Оксид і гідроксид кальцію – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.7. Оксид і гідроксид кальцію Оксид кальцію (технічні назви: негашене вапно, палене вапно, кипілка) – порошок білого кольору. У промисловості його добувають випалюванням вапняку, крейди чи інших карбонатних порід: СаСО3 = СаО + СО3; ∆Н° = […]...
- ГІДРОКСИД НАТРІЮ – ЛУЖНІ МЕТАЛИ Хімія – універсальний довідник ЛУЖНІ МЕТАЛИ ГІДРОКСИД НАТРІЮ Гідроксид натрію NаОН широко відомий під назвою їдкий натр. Цю назву (історично вона була першою) він отримав завдяки високій хімічній активності стосовно тваринних тканин – “їдкості” (як і гідроксиди всіх інших лужних металів). Його технічна назва – каустична сода. Гідроксид натрію – розчинна у воді основа, тобто […]...
- Електронна будова атомів металічних елементів – Загальні відомості про металічні елементи та метали ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.1. Загальні відомості про металічні елементи та метали Металічних елементів більше, ніж неметалічних: зі 118 відомих на початок 2012 р. елементів понад 90 – металічні. Усі металічні елементи утворюють прості речовини – метали. 8.1.1. Електронна будова […]...
- ПРОСТІ РЕЧОВИНИ. МЕТАЛИ Й НЕМЕТАЛИ, МЕТАЛІЧНІ Й НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ № 1. Прості речовини – це речовини, молекули яких складаються з елементів одного виду атомів. Залізо, алюміній, мідь, водень, кисень. № 2. Прості речовини поділяються на метали та неметали. До металів належать цинк Zn, калій К, кальцій Са, магній Mg, олово Sn, свинець Рb, мідь Сu, залізо Fe, алюміній Аl, срібло Ag, золото Аu. Прикладами […]...
- Фізичні властивості металів – Загальні відомості про металічні елементи та метали ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.1. Загальні відомості про металічні елементи та метали 8.1.2. Фізичні властивості металів Особливості металічного зв’язку і кристалічних граток зумовлюють загальні фізичні властивості різних металів. 1. Агрегатний стан металів твердий (крім ртуті й, умовно, францію1). Температура плавлення […]...
- Загальна характеристика – Урок 5 – Елементи IV групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.5. Елементи IV Групи 9.5.1. Загальна характеристика До складу головної підгрупи IV групи (14 групи) входять Карбон (С), Силіцій (Si), Германій (Ge), Станум (Sn) і Плюмбум (Рb). Будова зовнішнього електронного шару елементів – ns2nр2. Це p-елементи: […]...
- Тема 20. Кальцій Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА ІІ ЗАВДАННЯ ДЛЯ ПЕРЕВІРКИ ЗНАНЬ НЕОРГАНІЧНА ХІМІЯ Тема 20. Кальцій Серед чотирьох наведених варіантів відповідей виберіть одну правильну 1. Позначте символ хімічного елемента Кальцій: A. К; Б. Ка; B. Са; Г. С. 2. Позначте число протонів, що містить ядро атома Кальцію: A. 20; Б. 30; B. […]...