Карбонатна кислота та її солі
РОЗДІЛ 2 НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ
ХІМІЧНІ ЕЛЕМЕНТИ IVA ГРУПИ
§ 48. Карбонатна кислота та її солі
Усвідомлення змісту цього параграфа дає змогу:
Називати солі карбонатної кислоти за хімічною і тривіальною номенклатурами;
Характеризувати фізичні та хімічні властивості, способи добування, застосування карбонатної кислоти та її солей;
Складати рівняння відповідних хімічних реакцій.
Карбонатна кислота Н2СО3 відповідає кислотному карбон(ІV) оксиду СО2. Належить до двохосновних оксигеновмісних кислот. Модель молекули
– Складіть графічну та електронну формули карбонатної кислоти.
Чим зумовлена її двухосновність?
Унаслідок незначної полярності зв’язків О-Н карбонатна кислота є слабким електролітом. Дисоціює ступінчасто:
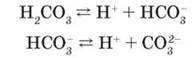
Карбонатна кислота нестійка, існує лише у водному розчині. У разі намагання виділити її з розчину, а також при нагріванні та тривалому зберіганні розкладається на воду і карбон(ІV) оксид, тому є леткою:
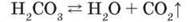
Як оксигеновмісну карбонатну кислоту одержують розчиненням карбон(ІV) оксиду у воді:
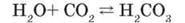
Така сама реакція відбувається під час виготовлення газованої води й утворення мінеральної води в природних умовах.
Солі карбонатної кислоти. Як двохосновна карбонатна кислота утворює два ряди солей – середні (карбонати) і кислі (гідрогенкарбонати). Для деяких солей цієї кислоти застосовують тривіальні назви:
Ма2СО3 – натрій карбонат, сода, пральна сода, кальцинована сода;
К2СО3 – калій карбонат, поташ;
МаНСО3 – натрій гідрогенкарбонат, питна сода;
Na2COg – 10Н20 – кристалогідрат натрій карбонату, кристалічна сода;
СаСО3 – кальцій карбонат, кальцит, вапняк, крейда, мармур.
Фізичні властивості. Усі карбонати – тверді речовини з йонною кристалічною граткою, більшість, за винятком карбонатів лужних елементів та амонію, – нерозчинні у воді. Більшість гідрогенкарбонатів, навпаки, добре розчиняються у воді, малорозчинний лише натрій гідрогенкарбонат.
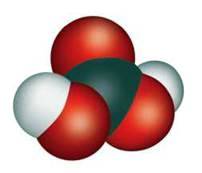
Мал. 80. Модель молекули карбонатної кислоти
Хімічні властивості солей карбонатної кислоти зумовлені, з одного боку, належністю їх до класу солей, з іншого – пов’язані з особливостями карбонатної кислоти, а саме її слабкістю, нестійкістю, леткістю, двохосновністю. Розглянемо найважливіші з них.
Взаємодія з кислотами. Під дією сильніших, ніж карбонатна, кислот на карбонати виділяється вуглекислий газ:
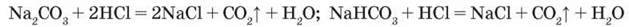
Скорочені йонні рівняння цих реакцій мають вигляд:
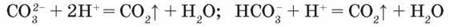
З них видно, що йони Гідрогену зв язуються карбонат-іонами так само, як під час взаємодії кислот з основами, тому для нейтралізації кислот можна використовувати карбонати. Ця властивість карбонатів знаходить застосування у сільському господарстві: для зниження кислотності і покращення структури грунтів до них вносять розмелений вапняк. Відбувається реакція:
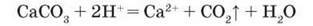
Цей процес називається вапнуванням грунтів.
Реакцію солей карбонатної кислоти з сильними кислотами використовують для їх виявлення.
Розкладання при нагріванні. У результаті нагрівання всі карбонати, крім карбонатів лужних елементів, розкладаються з виділенням вуглекислого газу:
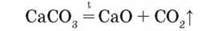
Гідрогенкарбонати лужних елементів при нагріванні перетворюються на карбонати:
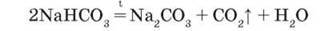
Інші – на оксиди:
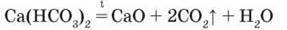
Взаємоперетворення карбонатів і гідрогенкарбонатів. Якщо через водний розчин карбонату Натрію або Кальцію пропустити вуглекислий газ, то карбонати перетворюються на гідрогенкарбонати:
Na2CO3 + CO2 + H2O = 2NaHCO3; СаСО3 + CO2 + H2O = Са(НС03)2 Нагріванням добутих розчинів можна знову одержати карбонати.
ЛАБОРАТОРНІ ДОСЛІДИ
ЯКІСНА РЕАКЦІЯ НА КАРБОНАТ – ТА ГІДРОГЕНКАРБОНАТ-ІОНИ
В одну пробірку насипте трохи (вкрити лише дно) крейди, в іншу налийте 2 мл розчину питної соди. У кожну додайте по 1 мл хлоридної кислоти, одразу закрийте пробками з газовідвідними трубками, які опустіть у пробірки з свіжоприготовленою вапняною водою. Спостерігайте утворення в обох пробірках з вапняною водою білого кристалічного осаду кальцій карбонату.
Продовжуйте пропускати вуглекислий газ крізь розчин з осадом однієї з пробірок. Спостерігайте розчинення осаду кальцій карбонату внаслідок перетворення його на кальцій гідрогенкарбонат. Прокип’ятіть цей розчин і спостерігайте утворення знову осаду кальцій карбонату.
Зробіть висновок про те, яка реакція є якісною на карбонати і гідрогенкарбонати та якою ознакою вона супроводжується; за яких умов відбувається взаємоперетворення карбонатів і гідрогенкарбона – тів. Складіть рівняння відповідних реакцій у послідовності їх перебігу в молекулярній та йонних формах.
Гідроліз карбонатів. Карбонати лужних елементів як солі слабкої двохосновної кислоти у водному розчині гідролізують з утворенням лужного середовища:
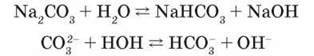
Карбонати трьохвалентних металічних елементів, наприклад алюміній карбонат, ферум(ІІІ) карбонат і хром(ІІІ) карбонат, зазнають повного гідролізу, внаслідок якого утворюються відповідні основи та вуглекислий газ. Тому при зливанні, зокрема, розчинів алюміній хлориду і натрій карбонату утворюються не продукти реакції обміну, а продукти повного гідролізу солі:
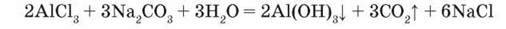
Саме тому в таблиці розчинності в клітинках цих солей стоять риски, які вказують на неможливість їх існування у водному розчині.
Добування. Деякі карбонати у великій кількості існують у природі в складі гірських порід і мінералів (див. мал. 68).
Інші карбонати добувають у промисловості та в лабораторії, користуючись відомими вам властивостями солей карбонатної кислоти і вуглекислого газу.
– Складіть чотири рівняння реакцій добування середніх і кислих солей карбонатної кислоти.
Застосування найважливіших карбонатів і гідрогенкарбонатів наведено у табл. 16.
Т а б л и ц я 16
Застосування солей карбонатної кислот
Формула солі, назва | Галузі застосування |
СаCО3 – крейда, мармур, вапняк | Будівельні матеріали, виробництво вапна, наповнювач паперу та гуми, основа зубних паст, вапнування грунтів |
Na2CO3, кальцинована сода | Виробництво скла, мила та інших мийних засобів, паперу, добування сполук Натрію |
NaHCO3, питна сода | У вогнегасниках, виробництві штучних мінеральних вод, як розпушувач тіста, лікувальний засіб |
К2СО3, поташ | Мінеральне добриво, у виробництві рідкого мила, тугоплавкого скла |
Коротко про головне
Карбонатна кислота є слабкою, нестійкою двохосновною кислотою, яка існує лише в розчині. Утворює два ряди солей – карбонати і гідрогенкарбонати. Добувають розчиненням вуглекислого газу у воді. Використовується в газованих напоях.
Солі карбонатної кислоти – кристалічні речовини з йонною граткою. Середні солі лужних елементів та амонію добре розчинні у воді, решта – мало або практично нерозчинні, кислі солі краще розчиняються, ніж середні. Виявляють характерні для солей властивості: взаємодіють з кислотами з виділенням вуглекислого газу, розкладаються за нагрівання (крім карбонатів лужних елементів). Карбонати і гідрогенкарбонати за певних умов взаємоперетворюються. Добувають за допомоги вуглекислого газу та природних карбонатів. Мають широке застосування у виробництві будівельних матеріалів, скла, мийних засобів, паперу, в сільському господарстві для вапнування грунтів, а також у медицині, побуті.
Для допитливих. У природній воді містяться гідрогенкарбонати Кальцію і Магнію. Якщо така вода просочується крізь склепіння печери і крапає униз, розчинені гідрогенкарбонати поступово перетворюються на карбонати. З плином часу з’являються мінеральні утворення у вигляді бурульок, трубочок тощо – сталактити. Водночас на дні печери аналогічно утворюються сталагміти – конусоподібні стовпчики, напливи тощо. Сталактити і сталагміти можуть з’єднуватися в колони заввишки до 30 м (мал. 81).

Мал. 81. Сталактити і сталагміти