Кількість речовини, молярна маса
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ
1. Основні хімічні поняття. Речовина
1.7. Кількість речовини, молярна маса
Кількість речовини п (або V, ню) – це фізична величина, яка визначає кількість частинок (молекул, атомів, йонів, йонних угруповань – асоціатів) у певній її порції. Одиницею вимірювання кількості речовини є моль.
Моль – це порція речовини, яка містить 6,02 · 1023 її формульних одиниць. Приблизно стільки атомів Карбону міститься в 12 г простої речовини вуглецю
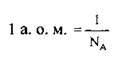
Будова речовини | Формульна одиниця | Приклад | Скільки частинок і яких містить 1 моль |
Молекулярна | Молекула | O2 | 6,02 · 1023 молекул кисню, або 2 · 6,02 · 1023 = 1,2 · 1024 атомів Оксигену |
NH3 | 6,02 · 1023 молекул аміаку, або 6,02 · 1023 атомів Нітрогену і 3 · 6,02 · 1023 = 1,806 · 1024 атомів Гідрогену | ||
Атомна | Атом | SiO2 | 6,02 · 1023 атомів Силіцію і 2 · 6,02 · 1023 = 1,2 · 1024 атомів Оксигену, що разом становить 1,806 · 1024атомів |
Mg | 6,02 | ||
Йонна | Йони (сукупність йонів) | КСl | 6,02 · 1023 пар йонів К+ і Сl – (6,02 · 1023 йонів К+ і 6,02 · 1023 йонів Сl-), разом – 1,204 · 1023 йонів |
СаСl2 | 6,02 · 1023 угруповань йонів (6,02 · 1023 йонів Са2+ і 2 · 6,02 · 1023 = 1,204 · 1024 йонів Сl-), разом – 1,806 · 1024 йонів |
Для обчислень використовують також поняття молярної маси речовини.
Молярна маса речовини М – це маса 1 моль речовини, яку виражено в грамах на моль (г/моль). Молярна маса речовини дорівнює відношенню маси речовини m (г) до кількості речовиниn (моль):
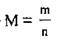
Виходячи з наведеної формули, можна обчислювати кількість речовини хімічної сполуки, маса якої відома, а також масу речовини, якщо відома кількість її речовини.
Молярні маси речовин (у г/моль) чисельно збігаються з відповідними атомними і молекулярними (а для речовин з йонною будовою – формульними) масами (у Да) і з відносними атомними та молекулярними масами:
– молярна маса Феруму дорівнює 56 г/моль;
– маса атома Феруму – 56 Да;
– відносна атомна маса атома Феруму – 56.
_________________________________________________________
1 Дальтон, Да (на честь Дж. Дальтона (1766-1844) – англійського хіміка, метеоролога і натураліста) – позасистемна одиниця для позначення мас елементарних частинок, атомних ядер, атомів і молекул.
2 У наш час атомна одиниця маси дорівнює 1/12 маси нейтрального атома 12С. До 1960-х років атомну масу визначали за кисневою шкалою, тобто вираховували через 1/16 маси нукліда 16O.
3 Число NA = 6,02214129(27) · 1023 моль-1 називають сталою (константою) Авогадро на честь італійського вченого Амадео Авогадро (1776-1856).