Кристалічні та аморфні речовини
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ
3. Хімічний зв’язок
3.8. Кристалічні та аморфні речовини
Більшість речовин у твердому стані утворює кристали. Кожний кристал має просторовий каркас правильної форми у вигляді кристалічних граток.
Кристал – це гігантська асоціація частинок, яка побудована за принципом правильно організованої геометричної структури з певним типом координації частинок. Навколо кожної з них розміщується (координується) певна обмежена кількість
Елементарна комірка – це найменший елемент кристала, який відповідає всім особливостям будови цього кристала; її поверхня обмежена площинами:- гранями, лінії перетину граней називають ребрами, а точки перетину ребер – вершинами. Відстані між частинками елементарної комірки називають параметрами граток, а самі частинки – вузлами. Залежно від того які частинки містяться у вузлах, говорять про різні типи кристалічних граток:
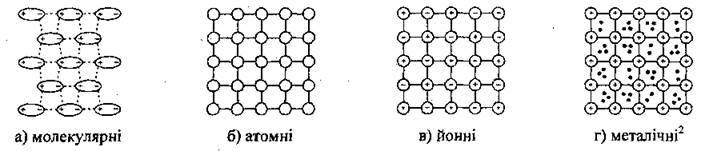
У вузлах молекулярних граток містяться молекули; вони зв’язані між собою міжмолекулярними зв’язками.
У вузлах атомних граток розміщено атоми. Це так само речовини з ковалентним зв’язком. До них належать: алмаз, карборунд SiC, силіцій діоксид SiО2, деякі інші неорганічні речовини. Такі речовини тверді, нелеткі, не розчиняються у воді, виявляють властивості діелектриків або напівпровідників.
Йонні гратки формують речовини з йонним типом зв’язку (наприклад, більшість оксидів металічних елементів); вони зв’язані між собою електростатичними силами (вони міцніші за молекулярні, але слабші за атомні). Такі речовини тверді, крихкі, нелеткі, у водних розчинах і в розплавам – провідники електричного струму. Зауважимо, що утворення йонних сполук супроводжується виділенням значної кількості енергії, чим і пояснюється неабияка міцність зв’язку. Самі ж йонні кристали – це утворення з доволі високими температурами плавлення й кипіння.
Йони можуть бути простими, як у кристалі КСl, і складними, як у кристалі (NH4)2SO4. Відповідно між іонами існує іонний зв’язок, а між атомами у самих іонах – ковалентний.
У вузлах металічних кристалічних граток розташовані йони металів, між якими вільно рухаються спільні електрони. Для них характерні металічний блиск3, висока електро – і теплопровідність, пластичність, високі температури плавлення. За нормальних умов метали – це тверді кристалічні речовини (крім ртуті Hg).
Тверді речовини, залежно від типу кристалічних граток, мають різні властивості:
Тип кристалічних граток | Частинки, що розміщуються у вузлах граток | Характер зв’язку між елементами кристала | Фізичні властивості речовин | Приклади речовин |
Атомні | Атоми | Міцні ковалентні зв’язки | Дуже тугоплавкі, дуже тверді, у воді не розчиняються, нелеткі | Алмаз (С), силіций (Si), карборунд (SiC) силіций(ІV) оксид (SiО2), графіт (С), червоний фосфор(Р) |
Йонні | Катіони й аніони | Електростатичні йонні зв’язки | Тугоплавкі, тверді, нелеткі, крихкі, більшість з них розчиняється у воді, розчини і розплави проводять електричний струм | Луги (КОН, NaOH), Солі (NaCl, КСl, KNO3, Ва(NO3)2), йонні гідриди (КН, СаН2) |
Молекулярні | Молекули | Слабкі сили міжмолекулярної взаємодії (зокрема і водневі зв’язки) | Мають незначну твердість, легкоплавкі, леткі, частина з них розчиняється у воді | Йод (І2), лід (Н2O), білий фосфор (Р), усі гази і більшість органічних речовин у твердому стані |
Металічні | Катіони | Металічний зв’язок між йонами металічних елементів і вільними електронами | Тверді, пластичні, ковкі; мають металічний блиск, Добре проводять електричний струм і тепло | Мідь (Cu), залізо (Fe), натрій (Na), срібло (Ag), а також сплави |
Існують речовини, кристали яких утворюють два типи зв’язку (йонний і атомний, атомний і металічний). Наприклад, структура графіту подібна до лусочок. Атоми кожної лусочки зв’язані ковалентними зв’язками і утворюють атомні кристалічні гратки, а атоми сусідніх лусочок зв’язані між собою металічним зв’язком.
Тип і форма граток значною мірою визначає властивості кристала. Велика частина кристалів анізотропні, тобто їхні властивості залежні від напрямку.
Якщо єдина кристалічна структура розповсюджується на все Тіло, то таке тіло називають монокристалом. Але чимало речовин мають кристалічну структуру, хоча зазвичай не мають характерної для кристалів форми. До таких речовин належать, наприклад, метали, “аморфний” вуглець, “аморфний” кремній. Дослідження показують, що такі речовини складаються з великої кількості дуже маленьких кристаликів – кристалічних зерен. Ці речовини називають полікристалічними.
Структурні одиниці деяких твердих тіл невпорядковані (не мають кристалічної структури). Такі тіла називають аморфними: силікатне скло, аморфна сірка, різні полімери, смоли, клеї тощо. Фізичні властивості аморфних тіл суттєво відрізняються від фізичних властивостей кристалічних. Найбільше значення мають ізотропія (однаковість показників тепло-, електропровідності, пружності, оптичних властивостей тощо в усіх напрямках) та в’язкість (процес, залежний від температури)4.
Деякі речовини можуть перебувати як в аморфному, так і в кристалічному стані (сірка).
Рідкий кристал – специфічний стан речовини, якому властиві риси як рідини (текучість), так і кристала (анізотропія). Найхарактернішу їхню властивість – зміну орієнтації молекул під впливом зовнішнього електричного поля – широко використовують в електроніці, термографії.
______________________________________________________
1 Цей тип зв’язку названо на честь голландського фізика Яна Дідеріка Ван дер Ваальса (1837-1923), лауреата Нобелівської премії з фізики (1910), який 1869 р. відкрив сили міжмолекулярної взаємодії.
2 Крапочками позначено електронний газ.
3 Металічний блиск мають і деякі неметали: графіт (вуглець), йод.
4 Аморфні тіла не мають температури плавлення. За умов підвищення температури вони поступово розм’якшуються і вище температури склування (Tg) переходять у рідкий стан. І навпаки, після охолодження нижче температури склування еластичні тіла втрачають пластичність і стають крихкими.