Нітратна кислота – НІТРОГЕН. ФОСФОР
Хімія підготовка до ЗНО та ДПА
Комплексне видання
ЧАСТИНА І
ЗАГАЛЬНА ХІМІЯ
ХІМІЯ ЕЛЕМЕНТІВ
НІТРОГЕН. ФОСФОР
Нітратна кислота
У молекулі нітратної кислоти HNО3 Нітроген перебуває в ступені окиснення +5, але при цьому проявляє валентність, що дорівнює 4. Будова молекули нітратної кислоти зображена нижче.
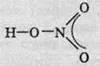
Пунктиром показана валентність, розподілена між двома атомами Оксигену й атомом Нітрогену; отже, електрони при утворенні зв’язку розподілені не між двома атомами, а між трьома.
Фізичні
Нітратна кислота за нормальних умов являє собою безбарвну, важку димну рідину (ρ = 1,52 г/см3), яка кристалізується при температурі -42 °С, а кипить при температурі +83 °С. Ця кислота має їдкий характерний запах. У твердому стані HNО3 є безбарвною кристалічною масою. При температурі близько +25 °С вона набуває червоного забарвлення унаслідок виділення бурого газу NО2. Нітратна кислота змішується з водою в будь-яких співвідношеннях. Як і сульфатна кислота, вона енергійно поглинає вологу, тобто проявляє гігроскопічні властивості.
Хімічні властивості нітратної кислоти
Нітратна
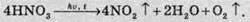
Нітратна кислота вступає у взаємодію з іншими речовинами по-різному, залежно від концентрації кислоти, від температури суміші й від ступеня роздрібнювання кристалічних речовин.
Взаємодія з металами
Нітратна кислота – дуже сильна кислота. У водних розчинах вона повністю дисоціює за такою схемою:
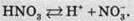
При взаємодії нітратної кислоти з металами водень виділяється тільки тоді, коли нітратна кислота дуже розведена (близько 1%) й реагує з лужними металами. При цьому спочатку відбувається реакція взаємодії металу з водою, а вже потім нейтралізація утвореного лугу кислотою:
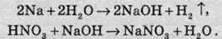
В інших випадках утворюється нітрат металу а нітратна кислота відновлюється до різних продуктів. Продукти взаємодії показані на схемі:
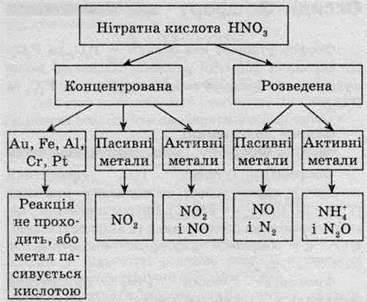
Завдяки тому, що концентрована нітратна кислота пасивує металічне залізо, її транспортують у сталевих бочках і цистернах. Нижче наведені приклади реакцій нітратної кислоти різної концентрації з деякими металами:
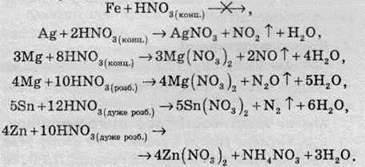
Насправді при відновленні нітратної кислоти утворюється не якийсь конкретний продукт, а суміш усіляких продуктів відновлення – амоніаку, азоту, оксидів Нітрогену та водню. У рівняннях реакції записують продукт, який переважає.
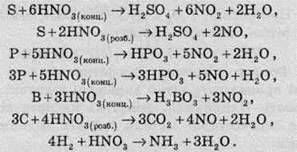
Взаємодія з неметалами
Нітратна кислота взаємодіє з багатьма неметалами. При цьому концентрована кислота відновлюється до нітроген діоксиду NО2, а розведена – до нітроген монооксиду NО:
Взаємодія зі складними сполуками
Нітратна кислота вступає у взаємодію з різними складними сполуками. За рахунок проявлення кислотних властивостей, HNО3 реагує з основами та основними оксидами:
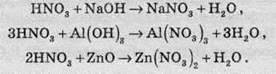
Нітратна кислота як окисник взаємодіє з багатьма сполуками, які здатні до окиснення:
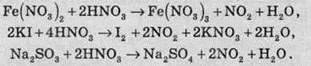
Чисту HNО3 або в суміші з концентрованою сульфатною кислотою використовують як гарний нітрувальний агент для добування нітрогеновмісних органічних сполук. Наприклад, для виробництва тротилу (або тринітротолуену) використовують суміш сульфатної та нітратної кислот:
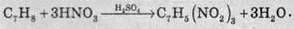
Методи добування нітратної кислоти
У промисловості нітратну кислоту добувають розчиненням нітроген діоксиду у воді в присутності надлишку кисню. NО2 добувають каталітичним окисненням амоніаку:
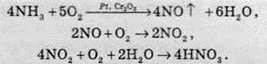
Невеликі кількості нітратної кислоти в лабораторіях добувають за такою реакцією:
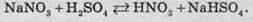
Застосування нітратної кислоти
Нітратну кислоту застосовують у багатьох галузях промисловості. Одне з головних застосувань HNО3 – це добування нітратних добрив. Нітратну кислоту також використовують для виготовлення різних вибухових речовин (порох, тротил, нітрогліцерин тощо), лікарських препаратів, яскравих барвників, штучних волокон (наприклад, нітроцелюлози, або “штучного шовку”). Її також застосовують як окисник ракетного палива.