Нітроген і Фосфор. Сполуки Нітрогену та фосфору – Неметали
Хімія
Неорганічна хімія
Неметали
Нітроген і Фосфор. Сполуки Нітрогену та фосфору
Нітроген і Фосфор
Елементи Нітроген і Фосфор розташовані в V групі Періодичної системи, Нітроген у 2-му періоді, Фосфор – у 3-му.
Електронна конфігурація атома Нітрогену:


Валентність Нітрогену: III і IV, ступінь окиснення в сполуках: від –3 до +5.
Будова молекули азоту:  ,
,  .
.
Електронна конфігурація атома Фосфору:
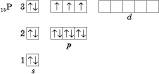

Електронна конфігурація атома Фосфору в збудженому стані:
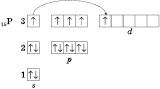

Валентність Фосфору: III і V, ступінь окиснення в сполуках: –3, 0, +3, +5.
Фізичні властивості азоту. Безбарвний газ без смаку й запаху, небагато легший за повітря
 г/моль,
г/моль,  г/моль), погано розчинний у воді. Температура плавлення –210 °С, кипіння –196 °С.
г/моль), погано розчинний у воді. Температура плавлення –210 °С, кипіння –196 °С.Алотропні модифікації Фосфору. Серед простих речовин, що утворює елемент Фосфор, найбільш поширені білий, червоний і чорний фосфор.
 . У повітрі об’ємна частка азоту складає 78,1 %, масова – 75,6 %. Сполуки Нітрогену в невеликих кількостях містяться в грунті. У складі органічних сполук (білки, нуклеїнові кислоти, АТФ) Нітроген міститься в живих організмах.
. У повітрі об’ємна частка азоту складає 78,1 %, масова – 75,6 %. Сполуки Нітрогену в невеликих кількостях містяться в грунті. У складі органічних сполук (білки, нуклеїнові кислоти, АТФ) Нітроген міститься в живих організмах.Поширення Фосфору в природі. Фосфор зустрічається в хімічно зв’язаному стані в складі мінералів: фосфоритів, апатитів, основна складова яких
 . Фосфор – життєво важливий елемент, входить до складу ліпідів, нуклеїнових кислот, АТФ, кальцій ортофосфату (у кістках і зубах).
. Фосфор – життєво важливий елемент, входить до складу ліпідів, нуклеїнових кислот, АТФ, кальцій ортофосфату (у кістках і зубах).Одержання азоту й фосфору.
Азот Одержують у промисловості з рідкого повітря: оскільки азот має найнижчу температуру кипіння з усіх атмосферних газів, із рідкого повітря він випаровується першим. У лабораторії азот одержують при термічному розкладанні амоній нітриту:  .
.
Фосфор Одержують з апатитів чи фосфоритів при прожарюванні їх із коксом і піском за температури  :
:

Хімічні властивості азоту.
1) Взаємодія з металами. Речовини, що утворюються в результаті цих реакцій, називаються нітридамИ.
За кімнатної температури азот реагує тільки з літієм:

З іншими металами азот реагує за високих температур:
 – алюміній нітрид
– алюміній нітрид
2) Взаємодія з неметалами.
Із воднем азот взаємодіє в присутності каталізатора за високого тиску і температури:
 – амоніак
– амоніак
За дуже високих температур (близько  ) азот реагує з киснем:
) азот реагує з киснем:
 – нітроген(ІІ) оксид
– нітроген(ІІ) оксид
Хімічні властивості фосфору.
1) Взаємодія з металами.
При нагріванні фосфор реагує з металами:
 – кальцій фосфід
– кальцій фосфід
2) Взаємодія з неметалами.
Білий фосфор самозаймається, а червоний горить при підпалюванні:
 – фосфор(V) оксид
– фосфор(V) оксид
За недостачі кисню утворюється фосфор(ІІІ) оксид (дуже отруйна речовина):

Взаємодія з галогенами:

Взаємодія із сіркою:

Амоніак
Молекулярна формула амоніаку:  .
.
Електронна формула: 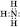
Структурна формула: 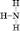
Фізичні властивості амоніаку. Безбарвний газ із характерним різким запахом, майже у два рази легший за повітря, отруйний. При збільшенні тиску чи охолодженні легко скраплюється в безбарвну рідину, температура кипіння  , температура плавління
, температура плавління  . Амоніак дуже добре розчиняється у воді: при
. Амоніак дуже добре розчиняється у воді: при  в 1 об’ємі води розчиняється до 700 об’ємів амоніаку, при
в 1 об’ємі води розчиняється до 700 об’ємів амоніаку, при  – 1200 об’ємів.
– 1200 об’ємів.
Одержання амоніаку.
1) Амоніак у лабораторії одержують нагріванням сухої суміші кальцій гідроксиду (гашеного вапна) і амоній хлориду (нашатирю):

2) Амоніак у промисловості одержують із простих речовин – азоту й водню:

Хімічні властивості амоніаку. Нітроген в амоніаку має найменший ступінь окиснення і тому виявляє тільки відновні властивості.
1) Горіння в атмосфері чистого кисню чи в підігрітому повітрі:

2) Окиснення до нітроген(II) оксиду в присутності каталізатора (розпечена платина):

3) Оборотна взаємодія з водою:

Наявність йонів  обумовлює лужне середовище розчину амоніаку. Отриманий розчин називається нашатирний спирт чи амоніачна вода. Йони амонію
обумовлює лужне середовище розчину амоніаку. Отриманий розчин називається нашатирний спирт чи амоніачна вода. Йони амонію  існують тільки в розчині. Виділити амоній гідроксид
існують тільки в розчині. Виділити амоній гідроксид  як самостійну сполуку неможливо.
як самостійну сполуку неможливо.
4) Відновлення металів з їхніх оксидів:

5) Взаємодія з кислотами з утворенням солей амонію (реакція з’єднання):
 – амоній нітрат.
– амоній нітрат.
Застосування амоніаку. Велика кількість амоніаку витрачається на одержання нітратної кислоти, нітрогеновмісних солей, сечовини, соди амоніачним методом. На легкому скрапленні й наступному випаровуванні з поглинанням теплоти засноване його застосування в холодильних установках. Водні розчини амоніаку використовують як нітратні добрива.
Солі амонію
Солі амонію – це солі, що містять як катіон групу  . Наприклад,
. Наприклад,  – амоній хлорид,
– амоній хлорид,  – амоній нітрат,
– амоній нітрат,  – амоній сульфат.
– амоній сульфат.
Фізичні властивості солей амонію. Білі кристалічні речовини, добре розчинні у воді.
Одержання солей амонію. Солі амонію утворюються при взаємодії газоподібного амоніаку чи його розчинів із кислотами:


Хімічні властивості солей амонію.
1) Дисоціація:

2) Взаємодія з іншими солями:

3) Взаємодія з кислотами:

4) Взаємодія з лугами:

Ця реакція є якісною на солі амонію. Амоніак, що виділяється, визначають за запахом чи посинінням вологого індикаторного паперу.
5) Розкладання при нагріванні:

Застосування солей амонію. Солі амонію застосовуються в хімічній промисловості і як мінеральні добрива в сільському господарстві.
Нітроген оксиди і фосфор оксиди
Нітроген утворює оксиди, у яких він виявляє ступінь окиснення від +1 до +5:  ; NO;
; NO;  ;
;  ;
;  ;
;  .
.
Усі нітроген оксиди отруйні. Оксид  має наркотичні властивості, які на початковій стадії позначаються ейфорією, звідси й назва – “звеселяючий газ”. Оксид
має наркотичні властивості, які на початковій стадії позначаються ейфорією, звідси й назва – “звеселяючий газ”. Оксид  подразнює дихальні шляхи і слизові оболонки очей. Шкідливий наслідок хімічного виробництва, він потрапляє в атмосферу у вигляді “лисячого хвоста” – червоно-брунатного забарвлення.
подразнює дихальні шляхи і слизові оболонки очей. Шкідливий наслідок хімічного виробництва, він потрапляє в атмосферу у вигляді “лисячого хвоста” – червоно-брунатного забарвлення.
Фосфор оксиди:  і
і  . Фосфор(V) оксид
. Фосфор(V) оксид  – найбільш стабільний оксид за звичайних умов.
– найбільш стабільний оксид за звичайних умов.
Одержання нітроген оксидів і фосфор оксидів.
При безпосередньому сполученні молекулярних азоту й кисню утворюється тільки нітроген(II) оксид:

Інші оксиди одержують непрямим шляхом.
Фосфор(V) оксид отримують при згорянні фосфору в надлишку кисню або повітря:

Хімічні властивості нітроген оксидів.
1)  – окисник, може підтримувати горіння:
– окисник, може підтримувати горіння:

Не реагує з водою і лугами.
2) NO – легко окиснюється:

Не реагує з водою і лугами.
3)  – кислотний оксид:
– кислотний оксид:

4)  – сильний окисник, кислотний оксид:
– сильний окисник, кислотний оксид:

У присутності надлишку кисню:

Димеризується, утворюючи оксид  – безбарвну рідину:
– безбарвну рідину:  . Реакція оборотна. При –11 °С рівновагу практично зміщено в бік утворення
. Реакція оборотна. При –11 °С рівновагу практично зміщено в бік утворення  , а при 140 °С – у бік утворення
, а при 140 °С – у бік утворення  .
.
5)  – кислотний оксид:
– кислотний оксид:

Хімічні властивості фосфор(V) оксиду. Фосфоровмісні кислоти.
 – типово кислотний оксид. Йому відповідають три кислоти: мета-, орто – і двофосфатнА. При розчиненні
– типово кислотний оксид. Йому відповідають три кислоти: мета-, орто – і двофосфатнА. При розчиненні  у воді спершу утворюється метафосфатна кислота:
у воді спершу утворюється метафосфатна кислота:

При тривалому кип’ятінні  з водою – ортофосфатна кислота:
з водою – ортофосфатна кислота:

При обережному прожарюванні ортофосфатної кислоти утворюється двофосфатна кислота:

Застосування нітроген оксидів та фосфор оксидів.
Нітроген(IV) оксид використовується у виробництві нітратної кислоти, нітроген(І) оксид – у медицині.
Фосфор(V) оксид використовують для осушування газів і рідин, а в окремих випадках – для відщеплення від речовин хімічно зв’язаної води.
Нітратна й фосфатна кислоти
Фізичні властивості ортофосфатної (фосфатної) кислоти. За звичайних умов – тверда, безбарвна, кристалічна речовина. Температура плавлення +42,3  . У твердій і рідкій кислоті молекули поєднуються за рахунок водневих зв’язків. Цим зумовлена підвищена в’язкість концентрованих розчинів фосфатної кислоти. Вона добре розчинна у воді, її розчин – електроліт середньої сили.
. У твердій і рідкій кислоті молекули поєднуються за рахунок водневих зв’язків. Цим зумовлена підвищена в’язкість концентрованих розчинів фосфатної кислоти. Вона добре розчинна у воді, її розчин – електроліт середньої сили.
Фізичні властивості нітратної кислоти. Безводна (100%-на) кислота – безбарвна рідина, що сильно пахне, температура кипіння  . У разі зберігання на світлі поступово забарвлюється в бурий колір, внаслідок розкладання та утворення вищих нітроген оксидів, у тому числі й бурого газу
. У разі зберігання на світлі поступово забарвлюється в бурий колір, внаслідок розкладання та утворення вищих нітроген оксидів, у тому числі й бурого газу  . Добре змішується з водою в будь-яких співвідношеннях.
. Добре змішується з водою в будь-яких співвідношеннях.
Одержання фосфатної кислоти.
1) З її солей, що містяться у фосфатних мінералах (апатитах і фосфоритах), при дії сульфатної кислоти:

2) Гідратацією фосфор(V) оксиду:

Одержання нітратної кислоти.
1) Із сухих солей нітратної кислоти при дії на них концентрованої сульфатної кислоти:

2) Із нітроген оксидів:

3) Промисловий синтез нітратної кислоти:
 – каталітичне окиснення амоніаку, каталізатор – платина.
– каталітичне окиснення амоніаку, каталізатор – платина.
 – окиснення киснем повітря.
– окиснення киснем повітря.
 – поглинання
– поглинання  водою в присутності кисню.
водою в присутності кисню.
Хімічні властивості фосфатної кислоти. Виявляє всі типові властивості кислот. Фосфатна кислота – триосновна, утворює два ряди кислих солей – дигідрофосфати І гідрофосфатИ.
1) Дисоціація:



2) Взаємодія з оксидами металів:

3) Взаємодія з основами:

4) Взаємодія із солями. Реакція з аргентум нітратом є якісною на йон  – випадає жовтуватий осад аргентум фосфату:
– випадає жовтуватий осад аргентум фосфату:


5) Взаємодія з металами, що стоять в електрохімічному ряді напруг до Гідрогену:

Хімічні властивості нітратної кислоти. Нітратна кислота – сильний окисник.
1) Дисоціація: 
2) Взаємодія з оксидами металів:

3) Взаємодія з основами:

4) Взаємодія із солями:

5) Взаємодія з металами. При взаємодії з металами концентрованої і розведеної нітратної кислоти утворюється сіль (нітрат), нітроген оксиди, азот або амоніак і вода.
Застосування ортофосфатної й нітратної кислот.
Ортофосфатна кислота Широко використовується у виробництві мінеральних добрив. Вона не отруйна й використовується в харчовій промисловості для виготовлення сиропів, напоїв (кока-коли, пепсі-коли).
Нітратна кислота Витрачається на виробництво нітратних добрив, вибухових речовин, ліків, барвників, пластмас, штучних волокон та інших матеріалів. Концентрована нітратна кислота застосовується в ракетній техніці як окисник ракетного палива.
Нітрати
Солі нітратної кислоти – нітратИ. Це тверді кристалічні речовини, добре розчинні у воді, токсичні. Натрій, Калій, Кальцій і амоній нітрати називають також селітрамИ.
Одержання нітратів.
1) Взаємодія нітратної кислоти з основами:

2) Взаємодія нітратної кислоти з основними оксидами:

3) Взаємодія нітратної кислоти з металами, амоніаком:


4) Взаємодія нітратної кислоти із солями:

Хімічні властивості нітратів. Нітрати мають хімічні властивості, які є типовими для солей (взаємодія з кислотами, солями, основами). Характерним є розклад при нагріванні. Продукти розкладу визначаються місцем металу в електрохімічному ряді напруг.
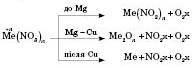
Наприклад:



Якісною реакцією на нітрат-іон  є нагрівання розчину випробуваної солі з концентрованою сульфатною кислотою і міддю. Сульфатна кислота витісняє нітратну з її солі та реагує з міддю, нарешті спостерігається виділення бурого газу:
є нагрівання розчину випробуваної солі з концентрованою сульфатною кислотою і міддю. Сульфатна кислота витісняє нітратну з її солі та реагує з міддю, нарешті спостерігається виділення бурого газу:


Застосування нітратів. В основному нітрати застосовуються у виробництві добрив, вибухових речовин, нітратної кислоти, а також скла, ліків, для обробки та консервування харчових продуктів.
Фосфати
Солі фосфатної кислоти – фосфатИ. Ортофосфатна кислота – триосновна кислота, тому вона утворює три ряди солей: середні – фосфати  і два ряди кислих солей – гідрофосфати
і два ряди кислих солей – гідрофосфати  і дигідрофосфати
і дигідрофосфати  . Кислі солі розчиняються у воді краще, ніж середні.
. Кислі солі розчиняються у воді краще, ніж середні.
Одержання фосфатів. Взаємодія ортофосфатної кислоти:
1) з основами:

2) оксидами металів:

3) металами, що стоять в електрохімічному ряді напруг до Гідрогену:

4) солями:

Хімічні властивості фосфатів. Фосфати мають усі типові хімічні властивості солей. Характерними для них є переходи від дигідро – до гідрофосфатів і фосфатів:



Кислі солі, до складу яких входять атоми Гідрогену, утворюються при надлишку кислоти в реакційній суміші.
Якісною реакцією на фосфат-йон  є взаємодія досліджуваної солі з аргентум нітратом. При цьому випадає жовтий осад
є взаємодія досліджуваної солі з аргентум нітратом. При цьому випадає жовтий осад  :
:
 .
.
Застосування фосфатів. Фосфати в основному застосовуються як мінеральні добрива, а також для виробництва фосфатних кислот, фосфору.
Мінеральні добрива
Речовини, що вносяться в грунт для підвищення врожайності, називаються добривамИ.
Нітратні добрива поділяються на дві групи: мінеральні (селітри  ,
,  ,
,  ,
,  , рідкий амоніак) та органічні (гній, компост, бобові рослини).
, рідкий амоніак) та органічні (гній, компост, бобові рослини).
Фосфатні добрива. Мінеральні солі поглинаються рослинами тільки в розчиненому вигляді, тому використовуються фосфатні добрива як кислі солі – вони краще середніх розчиняються у воді.
Найважливіші фосфатні добрива:
– подвійний суперфосфат  ,
,
– простий суперфосфат  ,
,
– преципітат  ,
,
– фосфоритне борошно  .
.
Комбіновані добрива містять декілька необхідних рослині елементів, наприклад:  ,
,  – амофоси містять Нітроген і Фосфор. Суміш амофосів із калійною селітрою називається “амофосна” і містить також калій.
– амофоси містять Нітроген і Фосфор. Суміш амофосів із калійною селітрою називається “амофосна” і містить також калій.