Обчислення за хімічними рівняннями
РОЗДІЛ 1 ПОВТОРЕННЯ ТА ПОГЛИБЛЕННЯ ТЕОРЕТИЧНИХ ПИТАНЬ КУРСУ ХІМІЇ ОСНОВНОЇ ШКОЛИ
§ 2. Обчислення за хімічними рівняннями
Усвідомлення змісту цього параграфа дає змогу:
Опанувати алгоритм розв’язування розрахункової задачі та позначення фізичних величин;
Обчислювати масу речовини за відомою кількістю речовини або кількість речовини за відомою масою; об’єм газуватої речовини (н. у.) за відомою масою або кількістю речовини і навпаки.
Ви вже розв’язували розрахункові задачі з хімії і розумієте, що систематичне їх
Щоб розв’язувати задачі за хімічними рівняннями, пригадайте, що таке хімічне рівняння, як його складають. Хімічні рівняння складають на основі закону збереження маси речовин.
– Пригадайте означення хімічного рівняння та формулювання закону збереження маси речовин.
За хімічними рівняннями можна робити різні розрахунки – обчислювати кількість речовини, масу, об’єм вихідних речовин або продуктів реакції.
1. Проаналізуйте умову задачі і з’ясуйте, що дано і що треба обчислити.
2. Запишіть скорочено умову і вимогу задачі, використовуючи при цьому загальновживані позначення величин та одиниці CI.
3. Запишіть рівняння хімічної реакції, необхідне для розрахунків.
4. Сплануйте логічну послідовність дій та оберіть спосіб розв’язування.
5. Розв’язуйте задачу в загальному вигляді через математичні рівняння, а числа підставляйте в остаточні рівняння.
6. Виконуйте розрахунки в тих одиницях вимірювання, які задані умовою задачі. Для спрощення розрахунків переводьте зазначені в задачі маси, об’єми речовин у кількість речовини, розглядаючи молярні співвідношення, які здебільшого є співвідношеннями малих простих чисел.
7. Заокруглюйте добуті результати до 0,01 або навіть до цілих чисел, користуючись правилами наближених розрахунків, і запишіть повну відповідь.
Пам’ятайте, що:
– коефіцієнти в хімічних рівняннях показують молярні співвідношення речовин;
– якщо хімічні рівняння описують реакції між газами, то коефіцієнти показують їх об’ємні співвідношення;
– розв’язувати задачу можна будь-яким способом, але краще обирати найраціональніший. При цьому не обов’язково дотримуватись певного шаблону в оформленні розв’язування. Важливо зрозуміти хімічну суть задачі, вміти проаналізувати її та правильно розв’язати.
■ Приклад 1. Унаслідок взаємодії з водою двохвалентного металу масою 6,0 г виділився водень об’ємом 3,36 л (н. у.). Визначте цей метал.
Р о з в ‘ я з а н н я
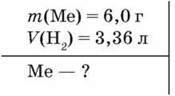
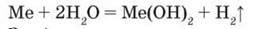
За рівнянням
N(Me) = n(H2) = 3,36 л : 22,4 л/моль = 0,15 моль.
Звідси молярна маса металу дорівнює:
М(Ме) = m : n = 6,0 г : 0,15 моль = 40 г/моль.
Отже, цей метал – кальцій.
В і д п о в і д ь. Кальцій Са.
Інший варіант р о з в ‘ я з а н н я:
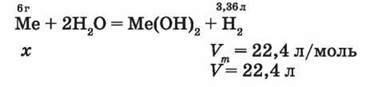
Згідно з рівнянням 6 г металу витискують з води водень об’ємом 3,36 л, а х г металу – 22,4 л/моль Н2, звідси

Отже, цей метал – кальцій, Аr(Са) = 40.
В і д п о в і д ь. Кальцій Са.
■ Приклад 2. Унаслідок прожарювання суміші цинк карбонату і цинк оксиду масою 1,6 г добуто цинк оксид масою 1,248 г. Визначте масову частку компонентів вихідної суміші.
Р о з в ‘ я з а н н я
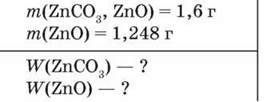
Припускаємо, що у вихідній суміші було х (г) ZnCO3, тоді m(ZnO) становила (1,6 – х) г.
Обчислюємо масу ZnO, яка утворюється в результаті прожарювання х (г) ZnCO3:
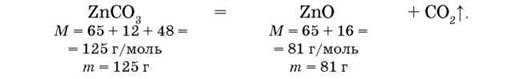
Із 125 г ZnCO3 утворюється 81 г ZnO, із х (г) ZnCO3 утворюється у (г) ZnO:
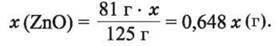
За умовою 0,648х + 1,6 – х = 1,248, або 0,648х – х = 1,248 – 1,6; х – 0,648х = 1,6 – 1,248; 0,352х = 0,352; звідси х = 1 г.
Отже, маса ZnCO3 в суміші дорівнює 1 г, а масова частка ZnCO3 становить:
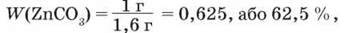
Тоді масова частка ZnO в суміші дорівнює:
W( ZnO) = 100 % – 62,5 % = 37,5 %.
В і д п о в і д ь. W(ZnCO3) = 62,5 %; W(ZnO) = 37,5 %.
I Коротко про головне
Рівняння хімічної реакції складається на основі закону збереження маси речовин. Воно відображає матеріальний баланс хімічного процесу, тобто за ним можна здійснювати різні розрахунки.
Щоб розв’язати розрахункову хімічну задачу, треба передусім зрозуміти її хімічну суть, правильно написати формули речовин, скласти рівняння хімічної реакції та виконати розрахунки, користуючись формулами, які виражають взаємозв’язок між фізичними величинами. При цьому слід використовувати одиниці СІ, для кожної з речовин застосовуючи одну й ту саму величину.