Оборотні й необоротні реакції. Хімічна рівновага
Тема 2
ХІМІЧНІ РЕАКЦІЇ
Урок 25
Тема уроку. Оборотні й необоротні реакції. Хімічна рівновага
Цілі уроку: формувати уявлення учнів про хімічну рівновагу; ознайомити з класифікацією реакцій на оборотні й необоротні; показати необхідність зсуву хімічної рівноваги; формувати уявлення про фактори, що впливають на зсув хімічної рівноваги.
Тип уроку: вивчення нового матеріалу.
Форми роботи: фронтальне опитування, самостійна робота, розповідь учителя.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, таблиця
ХІД УРОКУ
I. Організація класу
II. Актуалізація опорних знань.
Мотивація навчальної діяльності
1. Перевірка домашнього завдання, обговорення відповідей учнів про каталітичні реакції
2. Двоє учнів працюють біля дошки
За необхідності звертаємося до класу за доповненням відповідей учнів.
Завдання. Розгляньте реакцію й дайте відповіді на запитання.
1) Fe + CuCl2 = Cu + FeCl2
2) Fe + O2 = Fe2O3
А) Розставте коефіцієнти в рівняннях реакції.
Б) Запропонуйте умови, необхідні для того, щоб реакція почалася. Як ми побачимо, що вона протікає?
В) Запропонуйте
Г) Поясніть на молекулярному рівні, чому в разі підвищення температури швидкість більшості реакцій зростає.
Д) Як ми використовуємо в побуті вплив температури й тиску на швидкість хімічних реакцій?
3. Фронтальна бесіда
Наведіть приклади використання екзотермічних реакцій у життєдіяльності людини. Наведіть приклади екзотермічних реакцій, які становлять небезпеку для людини.
ІІІ. Вивчення нового матеріалу
Хімічна рівновага
Назвіть фактори, що впливають на швидкість хімічної реакції.
Розгляньмо рівняння реакції:
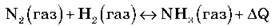
Дайте характеристику цієї хімічної реакції. (Реакція сполучення, каталітична, екзотермічна, окисно-відновна, оборотна)
Оборотні реакції – це такі хімічні реакції, які одночасно протікають і в прямому, і у зворотному напрямах.
Згадаймо умови необоротності хімічних реакцій іонного обміну. (Утворення нерозчинної речовини, газоподібної речовини, малодисоційованої речовини, наприклад води) У випадку синтезу амоніаку оборотність реакції зумовлена іншими причинами: установленням у системі хімічної рівноваги.
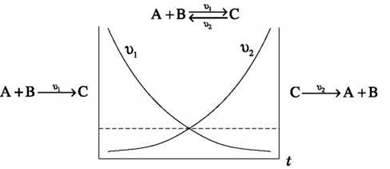
Хімічна рівновага – це стан системи, за якого швидкість прямої реакції (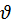 1) дорівнює швидкості зворотної реакції (
1) дорівнює швидкості зворотної реакції (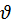 2). За хімічної рівноваги концентрації речовин залишаються незмінними. Хімічна рівновага має динамічний характер: пряма і зворотна реакції за умови рівноваги не припиняються.
2). За хімічної рівноваги концентрації речовин залишаються незмінними. Хімічна рівновага має динамічний характер: пряма і зворотна реакції за умови рівноваги не припиняються.
(Стан хімічної рівноваги кількісно характеризується константою рівноваги, що є відношенням констант прямої (К1) та зворотної (К2) реакцій.
Для реакції mA + nB 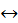 pC + dD константа рівноваги дорівнює:
pC + dD константа рівноваги дорівнює:
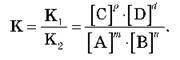
Константа рівноваги залежить від температури та природи реагентів. Чим більше значення константи рівноваги, тим більше рівновага зсунута в бік утворення продуктів прямої реакції.)
Способи зсуву рівноваги
Принцип Ле Шательє. Якщо на систему, що перебуває в стані рівноваги, чиниться зовнішній вплив (змінюються концентрація, температура, тиск), то це сприяє протіканню тієї із двох протилежних реакцій, що ослабляє цей вплив:
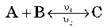
1. Тиск. Збільшення тиску (для газів) зміщає рівновагу в бік реакції, що веде до зменшення об’єму (тобто до утворення меншого числа молекул газоподібних речовин).

Збільшення P приводить до 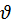 1 >
1 > 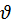 2.
2.
2. Температура. Підвищення температури зміщає рівновагу в бік ендотермічної реакції (тобто в бік реакції, що протікає з поглинанням теплоти).
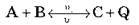
Збільшення t° приводить до 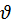 2 >
2 > 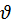 1.
1.
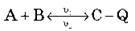
Збільшення t° приводить до 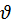 1 >
1 > 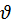 2.
2.
3. Збільшення концентрації вихідних речовин і вилучення продуктів зі сфери реакції зміщає рівновагу в бік прямої реакції. Збільшення концентрацій вихідних речовин [A] або [В] або [А] і [В]: 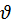 1 >
1 > 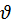 2.
2.
4. Каталізатори не впливають на стан рівноваги.
IV. Первинне застосування одержаних знань (керована практика)
Застосуймо ці положення для реакції синтезу амоніаку:
N2(газ) + Н2(газ) 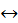 NH3(газ) + 92,4 кДж
NH3(газ) + 92,4 кДж
Оптимальні умови проведення синтезу амоніаку: t° > 400 °С, kat – Fe, Р .
.
Концентрація азоту й водню підвищується за рахунок рециркуляції азото-водневої суміші.
Виконання завдань на картці
Завдання 1
Укажіть, у який бік і чому зміститься рівновага реакції в разі:
А) підвищення температури:
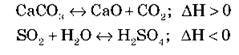
Б) підвищення тиску:
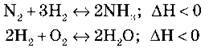
Спробуйте пояснити, у яких випадках температура й тиск не впливатимуть на зсув хімічної рівноваги. Чи є серед наведених реакцій такі реакції?
Завдання 2
Серед наведених реакцій укажіть ті, для яких підвищення тиску зміщує хімічну рівновагу вправо. Укажіть номери правильних відповідей за зростанням:
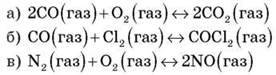
Завдання 3
Використовуючи принцип Ле Шательє, поясніть, у яких системах у разі підвищення температури рівновага зміститься:
А) уліво:
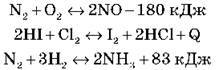
Б) управо:
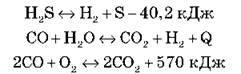
Завдання 4
Покажіть, у який бік зміститься в системі рівновага внаслідок зміни зовнішніх умов:
1) підвищення температури:
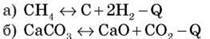
2) підвищення температури та збільшення концентрації речовин, що вступили в реакцію:
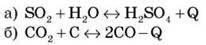
3) зменшення тиску:
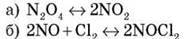
Поясніть, як агрегатний стан речовини може вплинути на зсув рівноваги оборотної реакції.
Завдання 5
Розгляньте рівняння реакцій оборотних процесів:
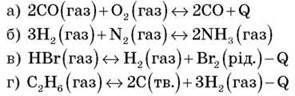
А) Укажіть екзотермічну й ендотермічну реакції.
Б) На яку із запропонованих реакційних систем впливатиме тиск?
В) Куди зміститься рівновага реакцій а і б унаслідок підвищення температури й тиску?
Г) Запропонуйте зовнішні впливи, з допомогою яких рівновага реакцій в і г зміститься в бік продуктів реакції.
Завдання 6
Запишіть рівняння зворотної реакції. Чому швидкість цих процесів значною мірою залежить від тиску?
А) SO2 + O2 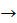 SO3
SO3
Б) NO + O2 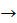 NO2
NO2
Поясніть, чому хімічну рівновагу називають динамічною.
V. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи.
Творче завдання. Допишіть рівняння запропонованих реакцій та обгрунтуйте причину протікання реакції до кінця:
А) H2S + O2 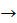
Б) NaOH + H3PO4 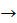
В) H2SO4 + BaCl 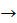
(Використайте варіанти відповідей:
А) один із продуктів залишає сферу реакції;
Б) утворюється слабкодисоційована речовина;
В) виділяється велика кількість енергії.)
Складіть розповідь про необоротні реакції для журналу “Апельсин”.
