ОБОРОТНІ РЕАКЦІЇ – ЕЛЕКТРОЛІТИ
Хімія – універсальний довідник
ЕЛЕКТРОЛІТИ
ОБОРОТНІ РЕАКЦІЇ
Реакція дисоціації води, рівняння якої наведено у попередньому параграфі, протікає незначною мірою. З кожного мільярда молекул води в ній беруть участь лише дві, тому концентрація кожного з іонів, які утворюються, мізерно мала (10-7 моль/л).
Коли кажуть, що вода – слабкий електроліт, то мають на увазі, що вона слабко дисоціює на iони. Крім води існує багато інших слабких електролітів, ступінь дисоціації яких, тобто частка молекул, що продисоціювала, незначна. У розчинах
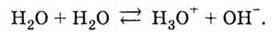
У спрощеній формі його можна записати так:
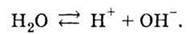
Реакції, які не проходять до кінця, тобто ведуть до встановлення рівноваги, називаються оборотними. Для позначення оборотності в рівнянні реакції замість знака рівності використовують знак “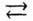 “.
“.
Реакція дисоціації води є оборотною. Інший приклад оборотної реакції – взаємодія води з аміаком.
Related posts:
- РЕАКЦІЇ В РОЗЧИНАХ ЕЛЕКТРОЛІТІВ – ЕЛЕКТРОЛІТИ Хімія – універсальний довідник ЕЛЕКТРОЛІТИ РЕАКЦІЇ В РОЗЧИНАХ ЕЛЕКТРОЛІТІВ У розчинах електролітів у хімічну взаємодію вступають іони. З’ясуємо, у яких випадках це відбувається. Якщо змішати водні розчини кухонної солі (хлориду натрію) і вапняної води (розчину гідроксиду кальцію), то зовнішніх змін не спостерігається. Формально можна написати З огляду на те, що всі чотири речовини (хлорид і […]...
- СИЛЬНІ І СЛАБКІ ЕЛЕКТРОЛІТИ – ЕЛЕКТРОЛІТИ Хімія – універсальний довідник ЕЛЕКТРОЛІТИ СИЛЬНІ І СЛАБКІ ЕЛЕКТРОЛІТИ Якщо реакція речовини з водою, яка призводить до утворення іонів, не проходить до кінця і у розчині залишаються молекули вихідної речовини, тобто процес електролітичної дисоціації оборотний, то така речовина належить до слабких електролітів. Крім описаних у попередньому параграфі води й аміаку, до слабких електролітів належать майже […]...
- Реакції іонного обміну – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.11. Реакції іонного обміну Згідно з теорією електролітичної дисоціації всі реакції у водних розчинах електролітів є реакціями між іонами. Вони називаються іонними реакціями, а рівняння цих реакцій – іонними рівняннями. Вони простіші, ніж рівняння реакцій, […]...
- Необоротні й оборотні реакції ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 4. ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ. § 4.5. Необоротні й оборотні реакції Реакції, які відбуваються тільки в одному напрямку і завершуються повним перетворенням вихідних реагуючих речовин у кінцеві речовини, називаються необоротними. Прикладом такої реакції може бути розклад хлорату калію (бертолетової солі) під час […]...
- Порядок реакції – Вираження швидкості реакції ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ 3. Вираження швидкості реакції 3.2 . Порядок реакції На основі теорії зіткнення для різних типів молекулярних реакцій можна записати вирази для швидкості реакції: Константа k – константа швидкості реакції. Через спільний вплив різних чинників на швидкість реакції результати експериментів часто не відповідають теоретичним припущенням. Тому певна реакція описується експериментально виведеним рівнянням (виразом) […]...
- Ступінь дисоціації. Сильні та слабкі електроліти Тема 1 РОЗЧИНИ Урок 13 Тема уроку. Ступінь дисоціації. Сильні та слабкі електроліти Цілі уроку: розширити знання учнів про електроліти; ознайомити з поняттями “сильні та слабкі електроліти”; показати кількісну характеристику процесу електролітичної дисоціації – ступінь дисоціації; закріпити навички складання рівнянь дисоціації кислот, основ і солей; визначити відмінності сильних і слабких електролітів. Тип уроку: комбінований урок […]...
- Оборотні й необоротні реакції. Хімічна рівновага Тема 2 ХІМІЧНІ РЕАКЦІЇ Урок 25 Тема уроку. Оборотні й необоротні реакції. Хімічна рівновага Цілі уроку: формувати уявлення учнів про хімічну рівновагу; ознайомити з класифікацією реакцій на оборотні й необоротні; показати необхідність зсуву хімічної рівноваги; формувати уявлення про фактори, що впливають на зсув хімічної рівноваги. Тип уроку: вивчення нового матеріалу. Форми роботи: фронтальне опитування, самостійна […]...
- Реакції обміну між розчинами електролітів, умови їх протікання Тема 1 РОЗЧИНИ УРОК 14 Тема уроку. Реакції обміну між розчинами електролітів, умови їх протікання Цілі уроку: показати процеси, що протікають у розчинах електролітів як реакції обміну між іонами; ознайомити з умовами їх протікання; формувати навички складання іонних рівнянь. Тип уроку: формування вмінь і навичок та їх творчого застосування. Форми роботи: розповідь учителя, демонстраційний експеримент, […]...
- Сильні та слабкі електроліти – ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ Сильні та слабкі електроліти Усі електроліти поділяють на сильні та слабкі. Сильні електроліти в розчинах дисоціюють повністю, а слабкі – частково, тобто частина молекул залишається в недисоційованому стані. До сильних електролітів відносять усі солі (за незначним винятком), луги (гідроксиди лужних металів, […]...
- Опис швидкості реакції – Швидкість реакції ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ 2. Швидкість реакції 2.3 . Опис швидкості реакції Швидкість реакції можна описати як зміну концентрації початкової речовини і як зміну продукту реакції за певний проміжок часу. І в одному і в іншому випадку за певний проміжок часу вона визначається за кутом нахилу січної відповідного графіка с(t). В один і той самий проміжок […]...
- Сильні й слабкі електроліти – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.10. Сильні й слабкі електроліти Розрізняють сильні й слабкі електроліти. Сильні електроліти під час розчинення у воді повністю дисоціюють на іони. До них належать: 1) майже всі солі; 2) багато мінеральних кислот, наприклад H2SO4, HNO3, […]...
- Чинники, що визначають швидкість реакції – Швидкість реакції ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ 2. Швидкість реакції 2.4 . Чинники, що визначають швидкість реакції Згідно з теорією зіткнення, реакція відбувається лише за певних умов: – частинки, які реагують між собою, повинні зіштовхнутися одна з одною; – частинки повинні зіштовхуватися в сприятливому для них положенні; – частинки повинні мати достатню кінетичну енергію, оскільки реакція проходить лише при […]...
- Радикальна полімеризація – Радикальні реакції ОРГАНІЧНІ РЕАКЦІЇ 2. Радикальні реакції 2.2. Радикальна полімеризація Полімеризація – це реакція, в якій дуже багато молекул низькомолекулярних речовин – мономерів, – з’єднуються один з одним у довгі ланцюги – полімери. Реакція починається за участю стартера (ініціатора) – активної молекули, яка розпадається під дією світла на радикали. Ці радикали можуть “атакувати” подвійні зв’язки, причому щоразу […]...
- Швидкість хімічної реакції – ХІМІЧНІ РЕАКЦІЇ ТА ЗАКОНОМІРНОСТІ ЇХ ПЕРЕБІГУ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ХІМІЧНІ РЕАКЦІЇ ТА ЗАКОНОМІРНОСТІ ЇХ ПЕРЕБІГУ Швидкість хімічної реакції Хімічні реакції відрізняються одна від одної тривалістю їхнього протікання. Деякі хімічні реакції відбуваються миттєво (наприклад, вибух воднево-кисневої суміші, реакції обміну з утворенням осаду), інші – досить швидко (горіння речовин), треті – повільно (більшість реакцій […]...
- Ступінь дисоціації – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.9. Ступінь дисоціації Оскільки електролітична дисоціація – процес оборотний, то в розчинах електролітів поряд з їх іонами є й молекули. Тому розчини електролітів характеризуються ступенем дисоціації (позначається грецькою буквою “альфа” а). Ступінь дисоціації – це […]...
- Зворотність реакції – Рушійна сила хімічних реакцій ЕНЕРГЕТИКА ХІМІЧНИХ РЕАКЦІЙ 3. Рушійна сила хімічних реакцій 3.5 . Зворотність реакції Відповідно до рівняння Гіббса-Гельмгольца, вільна енергія реакції ∆G0R залежить від температури. Якщо не враховувати залежність температури від ∆H0R і ∆S0R, то рівняння Гіббса-Гельмгольца відповідає рівнянню прямої. Залежно від знаків ∆H0R і ∆S0R розрізняють чотири типи реакції. Тип 1: при температурі Т < Т0 […]...
- КИСЛОТИ ЯК ЕЛЕКТРОЛІТИ – ЕЛЕКТРОЛІТИ Хімія – універсальний довідник ЕЛЕКТРОЛІТИ КИСЛОТИ ЯК ЕЛЕКТРОЛІТИ Властивості кислот можуть бути поділені на три групи. Перша група об’єднує загальні властивості кислот, зумовлені наявністю в їхніх розчинах іонів Гідрогену. Це – зміна забарвлення індикаторів, смак, взаємодія з металами, які стоять в ряді напруг металів лівіше Гідрогену, з основними оксидами, лугами, основами. Наведемо відповідні скорочені іонні […]...
- Швидкість хімічної реакції – Хімічні реакції Хімія Загальна хімія Хімічні реакції Швидкість хімічної реакції Швидкість хімічної реакції Визначається кількістю речовини, що прореагувала за одиницю часу в одиниці об’єму. Формула середньої швидкості хімічної реакції: де – середня швидкість хімічної реакції, – зміна концентрації реагенту, – час. Чинники, що впливають на швидкість хімічної реакції 1) Природа реагуючих речовин. 2) Агрегатний стан реагуючих речовин. […]...
- СОЛІ ЯК ЕЛЕКТРОЛІТИ – ЕЛЕКТРОЛІТИ Хімія – універсальний довідник ЕЛЕКТРОЛІТИ СОЛІ ЯК ЕЛЕКТРОЛІТИ При розчиненні у воді солі дисоціюють з утворенням позитивно заряджених іонів металу (або амонію NН4+) і негативно заряджених кислотних залишків. Ці іони і визначають поведінку солей у розчинах. Солі можуть взаємодіяти з кислотами: З лугами: З іншими солями: І тут, як і в усіх реакціях, які відбуваються […]...
- Фактори, що впливають на швидкість реакції ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 4. ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ. § 4.2. Фактори, що впливають на швидкість реакції Швидкість хімічної реакції залежить від природи речовин, що реагують, і умов перебігу реакції: концентрації с, температури t, наявності каталізаторів, а також від деяких інших факторів (наприклад, від тиску – […]...
- Молекулярність реакції – Вираження швидкості реакції ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ 3. Вираження швидкості реакції Згідно з теорією зіткнення, збільшення вдвічі кількості частинок реагенту в певному об’ємі веде до збільшення кількості зіткнень вдвічі і, відповідно, до збільшення швидкості реакції вдвічі. При збільшенні втричі концентрації частинок відбувається збільшення швидкості реакції втричі і т. д. 3.1 . Молекулярність реакції Реакції, в яких від початкових речовин […]...
- Реакції в розчинах електролітів. Складання молекулярних і йонно-молекулярних рівнянь ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини 6.10. Реакції в розчинах електролітів. Складання молекулярних і йонно-молекулярних рівнянь За нормальних умов тверді речовини зазвичай не вступають між собою в хімічні реакції. Хоч би один з реагентів повинен бути в газоподібному чи рідкому (розчиненому) стані. Отже, у хімії […]...
- ТЕПЛОВИЙ ЕФЕКТ РЕАКЦІЇ. ЕНТАЛЬПІЯ РЕАКЦІЇ – ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ Хімія – універсальний довідник ХІМІЧНИЙ ПРОЦЕС ТЕРМОДИНАМІКА ХІМІЧНОГО ПРОЦЕСУ ТЕПЛОВИЙ ЕФЕКТ РЕАКЦІЇ. ЕНТАЛЬПІЯ РЕАКЦІЇ Кількість теплоти Q, яку передали системі, йде на зміну її внутрішньої енергії ΔUі на здійснення системою роботи* W проти зовнішніх сил (зовнішнього тиску р) (рис. 32): Рис. 32. Робота, яку виконує хімічна система проти зовнішнього тиску (поршень невагомий). Вуглекислий газ, який […]...
- Вільна енергія реакції Гіббса – Рушійна сила хімічних реакцій ЕНЕРГЕТИКА ХІМІЧНИХ РЕАКЦІЙ 3. Рушійна сила хімічних реакцій 3.4. Вільна енергія реакції Гіббса Кожна реакція характеризується двома тенденціями: – система речовин прагне перейти у стан з якомога меншою ентальпією; – система речовин прагне перейти в стан з якомога більшою ентропією. Тому реакція Проходить самочинно в той бік, де знижується ентальпія реакції і зростає її ентропія. […]...
- Швидкість хімічної реакції, залежність швидкості реакції від різних факторів Тема 2 ХІМІЧНІ РЕАКЦІЇ Урок 23 Тема уроку. Швидкість хімічної реакції, залежність швидкості реакції від різних факторів Цілі уроку: формувати уявлення учнів про швидкість хімічної реакції, вплив на неї різних факторів; показати залежність швидкості хімічної реакції від природи речовини, температури, концентрації; розвивати навички й уміння складати рівняння хімічних реакцій, розпізнавати типи реакцій за рівняннями реакції; […]...
- Механізм утворення естерів – Реакції естерифікації ОРГАНІЧНІ РЕАКЦІЇ 4. Реакції естерифікації Реакцію обміну спиртів з карбоновими кислотами називають реакцією естерифікації, при відщеплюванні води утворюються естери. Приклад. Із метанової (мурашиної) кислоти і метанолу утворюється метиловий естер метанової кислоти: Естерифікація оборотна (омилення) і веде до встановлення рівноваги між початковими речовинами і продуктами реакції. Механізм утворення естерів Оскільки дана реакція оборотна, то й усі […]...
- Хімічні реакції. Схеми реакцій, хімічні рівняння – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція 4.1. Хімічні реакції. Схеми реакцій, хімічні рівняння Хімічними реакціями називають перетворення однієї чи декількох речовин, які відрізняються одна від одної складом чи будовою молекули, на інші. Речовини, які вступають у хімічні реакції, називають вихідними речовинами, або реагентами, а речовини, які […]...
- Електролітична дисоціація – Розчини Хімія Загальна хімія Розчини Електролітична дисоціація Речовини, розчини або розплави яких проводять електричний струм, називаються електролітамИ. Речовини, розчини або розплави яких не проводять електричного струму, називаються неелектролітамИ. Розпад електролітів на йони під час їхнього розчинення у воді називається електролітичною дисоціацієЮ. Основні положення теорії електролітичної дисоціації 1) Електроліти під час розчинення у воді розпадаються (дисоціюють) на […]...
- Ентальпія реакції – Перетворення енергії в хімічних реакціях ЕНЕРГЕТИКА ХІМІЧНИХ РЕАКЦІЙ 1 . Перетворення енергії в хімічних реакціях 1.3 . Ентальпія реакції Енергію, що виділилася або була поглинута в ході хімічної реакції, називають ентальпією реакції ∆HR або тепловим ефектом реакції. Значення цієї енергії легко визначити, якщо відомі ентальпії утворення ∆Hf відповідних речовин, що беруть участь у реакції. Тепловим ефектом реакції є різниця енергії […]...
- Ентропія реакції – Рушійна сила хімічних реакцій ЕНЕРГЕТИКА ХІМІЧНИХ РЕАКЦІЙ 3. Рушійна сила хімічних реакцій 3.3. Ентропія реакції У кожній реакції впорядкований стан системи змінюється і, отже, змінюється ентропія. Зміна ентропії реакції ∆SR, як і ентальпії реакції, визначається як різниця суми ентропій продуктів реакції і суми ентропій початкових речовин: Приклад. Під час реакції газоподібного гідроген хлориду з газоподібним амоніаком з двох “невпорядкованих” […]...