Оксиди Карбону – Елементи IV групи
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ
9. Неметалічні елементи та їхні сполуки. Неметали
9.5. Елементи IV Групи
9.5.3. Оксиди Карбону
Карбон утворює два оксиди – карбон(ІІ) оксид СО та карбон(ІV) оксид СO2 зі ступенями окиснення Карбону відповідно +2 та +4.
Карбон(ІІ) оксид, карбон монооксид
Атом Карбону в цьому оксиді перебуває в основному стані (6С 1s22s22p2) і має одну вакантну р-орбіталь. У його молекулі є два зв’язки між атомами С та О, що утворюються за обмінним механізмом,
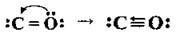
Отже, валентність Карбону й Оксигену в CO – III. Молекула лінійна і малополярна (причому частковий негативний заряд зосереджено на атомі Карбону, а позитивний – на атомі Оксигену, хоча його електронегативність і вища).
Карбон(ІІ) оксид – це газ, без кольору і запаху (а тому дуже небезпечний1), без смаку, отруйний, оскільки з гемоглобіном крові швидко утворює стабільну сполуку – карбоксигемоглобін.
Добування карбон(ІІ) оксиду
У лабораторії добувають при нагріванні мурашиної кислоти за наявності концентрованої
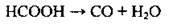
У промисловості добувають кількома способами:
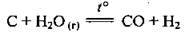
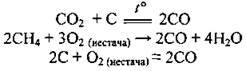
Хімічні властивості карбон(ІІ) оксиду
Карбон(ІІ) оксид СО – несолетворний оксид, не розчиняється у воді, у розчинах лугів і кислот. Типовий відновник:
– горить синім полум’ям з утворенням вуглекислого газу:
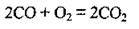
– реагує з водяною парою:
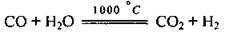
– чадний газ легко відновлює метали з оксидів металічних елементів:
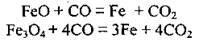
– відновлює солі Ag, Pd, Pt, Au. Так, реакцію взаємодії паладій (II) хлориду PdCl2 з чадним газом використовують для виявлення СО (утворюється чорний осад паладію):
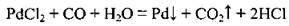
– із твердим натрій гідроксидом СО взаємодіє під тиском, утворюючи натрій форміат:
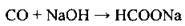
– при нагріванні і дії тиску чадний газ СО сполучається з аміаком, утворюючи синильну кислоту:
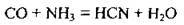
Карбон(ІV) оксид
Карбон(ІVУ) оксид (карбон діоксид, вуглекислий газ, вугільний ангідрид) СO2. Структурна формула: 0=С=0. Молекула утворюється за допомогою ковалентного полярного зв’язку. Карбон(ІV) оксид – газ без кольору і запаху, важчий за повітря, погано розчиняється у воді. За атмосферного тиску у рідкому стані не існує: при -78,5 °С твердне – утворюється сухий лід, який має молекулярні кристалічні гратки. Сухий лід не плавиться, а переходить у газоподібний стан (сублімує). Температура плавлення (під тиском) – ————————- 57 °С.
Добування карбон(ІV) оксиду
У природі вуглекислий газ утворюється постійно при повільному окисненні під час біохімічних процесів, а саме дихання, бродіння, гниття.
У лабораторії вуглекислий газ добувають дією на вапняк хлоридної кислоти:
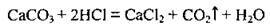
Можливе і використання інших карбонатів, зокрема гідрогенкарбонатів:
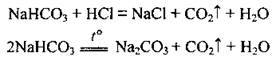
У промисловості вуглекислий газ добувають випалюванням вапняку:
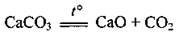
Збирають вуглекислий газ, добутий у лабораторії, способом витіснення повітря, використовуючи склянку, яка розміщена дном донизу, тому що він важчий за повітря.
Хімічні властивості карбон(ІV) оксиду
СO2 – кислотний оксид зі слабо вираженими (при дуже високих температурах) окислювальними властивостями. Має загальні властивості кислотних оксидів:
– при розчиненні у воді утворюється невелика кількість карбонатної кислоти:
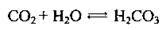
– взаємодіє з лугами, утворюючи кислі або середні солі:
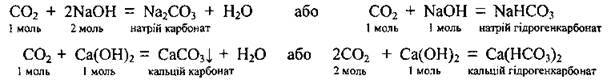
Для виявлення вуглекислого газу проводять реакцію з вапняною водою:
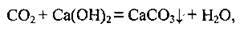
А далі при пропусканні вуглекислого газу осад зникає, бо утворюється розчинна у воді кисла сіль (якісна реакція на карбон(IV) оксид):
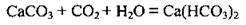
– взаємодіє з розчинами карбонатів, силікатів:
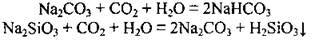
– взаємодіє з основними та амфотерними оксидами:
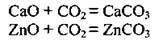
– взаємодіє з деякими активними металами (Mg, К) за дуже високих температур (С02 виступає як слабкий окисник):

– взаємодіє з розжареним коксом:
СO2 + С = 2СО
– при підвищеному тиску та при нагріванні сполучається з аміаком, утворюючи карбамід (сечовину):
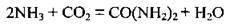
– вуглекислий газ використовують зелені рослини під час фотосинтезу:
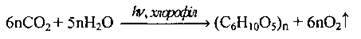
Карбон(ІV) оксид використовують у виробництві соди, цукру, мінерального добрива карбаміду; для гасіння пожеж, зберігання харчових продуктів (сухий лід), приготування газованих напоїв.
________________________________________________________________
1 Через що він отримав свою тривіальну назву чадний газ. У недалекому минулому, коли палили у грубках, через передчасне закриття заслінки димоходу нерідко траплялися масові отруєння (вчадіння) і навіть смерті. Адже концентрація в повітрі > 0,1 % призводить до смерті за одну годину. Зараз для запобігання отруєнню цим газом пожежні, крім звичайного протигазу, застосовують гопкалітові патрони, які містять каталітичну суміш (оксидів Мангануму, Купруму й Аргентуму) і сприяють перетворенню чадного газу на вуглекислий.