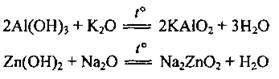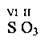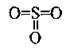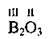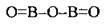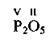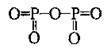Основні оксиди – Оксиди – Основні класи неорганічних сполук
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ
7. Основні класи неорганічних сполук
7.1. Оксиди
Оксиди – це бінарні сполуки елементів з Оксигеном, у яких він виявляє ступінь окислення -2. Характерні Ознаки оксидів:
– ступінь окиснення Оксигену – -2;
– атоми Оксигену не зв’язані між собою, а сполучаються лише з атомами інших елементів;
– атоми елемента, що утворює оксид, мають однаковий ступінь окиснення1.
Графічні формули оксидів
Валентність | Графічна формула |
|
|
|
|
|
|
Не всі бінарні сполуки Оксигену є оксидами:
Речовина | Формула | Графічна формула | Ступінь окиснення Оксигену |
Гідроген пероксид | H2O2 | H-O-O-H | -1 |
Натрій пероксид | Na2O2 | Na-O-O-Na | -1 |
Оксиген | OF2 | F-O-F | +2 |
За хімічним характером оксиди поділяють на несолетворні і солетворні.
Несолетворні оксиди – NO, N2O, CO, SiO – це оксиди, які відносять до реакційно здатних сполук, але під час реакцій солі не утворюються. Вони не реагують з водою, кислотами й основами за звичайних умов (отже, до класу оксидів їх відносять умовно).
Солетворні оксиди – це оксиди, які утворюють солі. Солетворні оксиди поділяють на основні (К2O, ВаО, MgO, FeO), кислотні (SO2, SO3, N2O5, P2O5) та амфотерні (ZnO, Аl2О3, Cr2O3, BeO).
Номенклатура оксидів
Назва оксидів складається з назви елемента, після якої, коли елемент виявляє кілька ступенів окиснення, у дужках римськими цифрами вказують ступінь його окиснення і додають слово “оксид”. Наприклад:
– К2O – калій оксид;
– Fe2O3 – ферум(ІІІ) оксид;
– Сu2O – купрум(І) оксид;
– MgO – магній оксид;
– Р2O5 – фосфор(V) оксид;
– Аl2O3 – алюміній оксид;
– СО – карбон(ІІ) оксид.
Деякі, давно відомі людині оксиди мають і тривіальні назви: СаО – негашене вапно, СO2 – вуглекислий газ, SO2 – сірчистий газ.
Добування оксидів
1. Взаємодія простих речовин (металів і неметалів) з киснем:
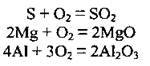
2. Окиснення складних речовин:
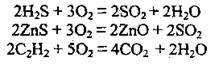
3. Термічний розклад:
– основ:
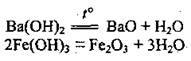
– солей:
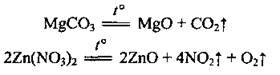
– амфотерних гідроксидів:
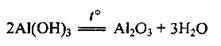
– деяких кислот:
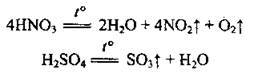
4. Під час деяких інших реакцій:
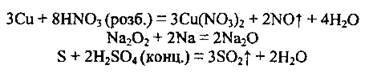
______________________________________________________
1 Подвійний “оксид” (FeFe2)O4 містить Ферум з різними ступенями окиснення (+2 і +3) і при взаємодії з кислотними оксидами утворює дві різні солі.
7.1.1. Основні оксиди
Основні оксиди – це оксиди, гідрати яких є основами. Усі основні оксиди є оксидами металічних елементів, які виявляють невисокі ступені окиснення (+1, +2). До основних оксидів належать:
– оксиди металічних елементів головних підгруп, І і II груп (крім Be);
– оксиди одновалентних елементів, двовалентних, за винятком BeO, ZnO, РbО, які є амфотерними;
– оксиди перехідних металічних елементів у найнижчих ступенях окиснення (NiO, FeO, МnО, СrO).
Основним оксидам відповідають основи:
Na2O – NaOH
MgO – Mg(OH)2
FeO – Fe(OH)2
BaO – Ba(OH)2
CrO – Cr(OH)2
Тип хімічного зв’язку в основних оксидах переважно йонний.
Хімічні властивості основних оксидів
1. Взаємодія з кислотами з утворенням солей:
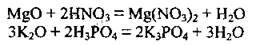
2. Взаємодія з кислотними оксидами з утворенням солей:
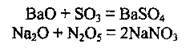
3. Взаємодія з водою. Лише оксиди лужних і лужноземельних металічних елементів взаємодіють з водою, утворюючи луги:
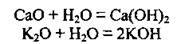
4. Взаємодія з амфотерними оксидами. Реакція відбувається під час сплавляння. Амфотерний оксид у цій реакції виявляє кислотні властивості:
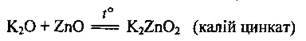
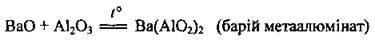
5. Взаємодія з амфотерними основами. Реакція відбувається під час сплавляння: