Періодична система хімічних елементів Д. Менделєєва. Структура періодичної системи
Тема 1 Початкові хімічні поняття
& 8. Періодична система хімічних елементів Д. Менделєєва. Структура періодичної системи
Опанувавши цю тему, ви зможете:
– знати структуру періодичної системи, розташування металічних і неметалічних елементів у періодичній системі;
– користуватися системою хімічних елементів як довідковою таблицею;
– уміти визначати відносні атомні маси хімічних елементів, порядок розташування елементів у періодичній системі;
– набувати здатності застосовувати довідкові джерела інформації.
–
Хімічній науці нині відомо 118 хімічних елементів. Вивчити й запам’ятати кожний елемент досить складно. Тому навіть тоді, коли хімічних елементів було відомо значно менше, учені вже працювали над створенням їх класифікації.
Класифікація хімічних елементів. Перший поділ елементів було здійснено з урахуванням фізичних властивостей простих речовин, утворених цими елементами. Так було виокремлено дві групи елементів – металічні й неметалічні (рис. 37).
До металічних елементів були віднесені Натрій, Калій, Кальцій, Барій, Манган, Ферум, Хром та
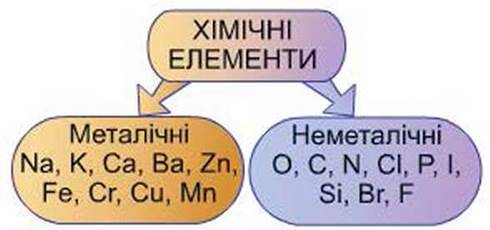
Рис 37. Класифікація хімічних елементів
Як неметалічні елементи класифікували Гідроген, Карбон, Сульфур, Силіцій, Фосфор, Хлор, Бром, Оксиген, Нітроген. Ці елементи утворюють речовини-неметали.
Метали й неметали різняться фізичними властивостями.
Однак з’ясувалося, що ця класифікація є неточною. Серед елементів і речовин, утворених ними, трапляються й такі, що поєднують у собі металічні й неметалічні властивості. Наприклад, неметали вуглець і силіцій мають металічний блиск, йод – електропровідний, а металічні елементи Цинк і Алюміній проявляють подвійні властивості у своїх сполуках.
Отже, така класифікація елементів виявилася недосконалою. Це наштовхнуло вчених на подальші пошуки.
Структура періодичної системи. У 1869 р. учений Д. Менделєєв представив таблицю класифікації хімічних елементів, яка пізніше дістала назву Періодична система хімічних елементів Д. Менделєєва.
Менделєєв Дмитро Іванович (1834- 1907) – російський учений, відомий як творець періодичного закону. Вивчаючи нафту та її походження, Д. Менделєєв подав ідею підземної газифікації вугілля, розробив склад і спосіб виробництва бездимного пороху. Опираючись на періодичний закон, учений передбачив існування ще не відкритих хімічних елементів, описав їхні фізичні й хімічні властивості. Як професор і керівник кафедри, був добрим лектором і великим другом студентської молоді.

Щоб зрозуміти, чому таблицю назвали системою, з’ясуємо, що ж таке система. У перекладі з грецької – “ціле, що складається з частин”. Проте система існує тоді, коли між її частинами виявлено взаємозв’язки, які надають їй певних нових якостей як цілості.
Найпоширенішими стали два варіанти періодичної системи: короткий і довгий. Для вивчення курсу хімії в основній школі частіше використовують короткий варіант (див. форзац 1).
Розглянемо таблицю та навчимося користуватися нею як довідковою. Усі елементи в періодичній системі Д. Менделєєв пронумерував. Номер, що його отримав кожний з хімічних елементів, називають порядковим номером.
Кожний елемент розміщено в окремій клітинці періодичної системи. Клітинки хімічних елементів об’єднано в періоди й групи. Така структура періодичної системи утворилась, коли ряд елементів, розташованих у порядку збільшення їх відносних атомних мас, Д. Менделєєв поділив на коротші ряди, що починатися найхарактернішим металічним (Li, Na, К, Rb, Cs, Fr) і завершувалися неметалічним (F, Cl, Br, I, At) елементами. Дослідивши властивості цих елементів і їх речовин, він виявив, що зі зростанням порядкових номерів у інших спостерігається плавна зміна металічних властивостей на неметалічні. Після відкриття інертних елементів (Не, Ке, Аr, Кr, Хе, Rn) їх було розміщено в кінці кожного ряду. Так сформувалися горизонтальні ряди – періоди.
Періоди – це горизонтальні ряди хімічних елементів, розташованих за зростанням їх порядкових номерів, що починаються металічними й закінчуються інертними елементами.
Періодична система складається із семи періодів, які містять неоднакову кількість елементів: перший період – 2, другий і третій – по 8, четвертий і п’ятий – по 18, шостий – 32, сьомий період містить 26 елементів і є незавершеним. Найкоротший – перший період, що складається лише з Гідрогену II і Гелію Не. За кількістю елементів у періоді їх поділяють на малі (перший – третій) і великі (четвертий – сьомий) (рис. 38).

Рис. 38. Класифікація періодів
У кожному періоді, незалежно від того, малий він чи великий, спостерігається одна й та сама закономірність: зі зростанням порядкових номерів елементів їх металічні властивості послаблюються, а неметалічні посилюються. Тому, скориставшись таблицею, за розташуванням елементів у періодах можна визначити, який це елемент – металічний чи неметалічний.
Унаслідок розташування періодів один під одним утворилося 8 груп (у короткому варіанті). Кожна з них поділяється на головну й побічну підгрупи.
У короткому варіанті напис символів елементів головної підгрупи зміщують в один бік, а побічної – в інший (рис. 39). Як бачимо, головна підгрупа містить елементи малих (другого й третього) і великих (четвертого – сьомого) періодів. До головних підгруп входять металічні й неметалічні елементи.
Побічні підгрупи складаються з металічних елементів великих періодів.
Особливу будову має VIII група. Її головна підгрупа – це інертні елементи, а побічна складається з трьох тріад:
Ферум Fe, Кобальт Со, Нікель Ni; Рутеній Ru, Родій Rh, Паладій Pd; Осмій Os, Іридій Іr, Платина Pt. Вони характеризуються подібністю властивостей, тому їх об’єднують у природні родини.
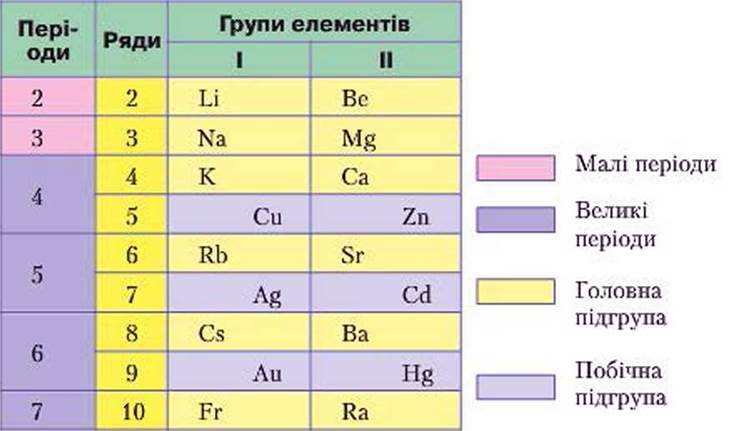
Рис. 39. Розташування елементів головних і побічних підгруп
Групи – це вертикальні стовпці хімічних елементів.
У групах теж існують закономірності. Зокрема у головних підгрупах зі зростанням порядкових номерів (зверху донизу) посилюються металічні й послаблюються неметалічні властивості елементів.
Розміщення елементів за періодами та групами полегшує їх вивчення. Знаючи будову та властивості атома одного з хімічних елементів, можна передбачувати будову та властивості атомів інших, що входять до складу цієї групи чи підгрупи.
Якщо в таблиці класифікації хімічних елементів Д. Менделєєва провести умовну діагональ від Бору до Астату, то зліва й знизу від неї будуть розташовані тільки металічні елементи, справа та вгорі від діагоналі в головних підгрупах – неметалічні елементи, а в побічних – металічні.
Яку ж інформацію ми можемо отримати з кожної клітинки періодичної системи? Насамперед вона містить символ хімічного елемента та його назву, порядковий помер, що мас зовсім інший зміст після відкриття будови атома, значення відносної атомної маси (рис. 40 а).
Якщо назви хімічного елемента та простої речовини не збігаються, то вказується ще й назва простої речовини (рис. 40 6).
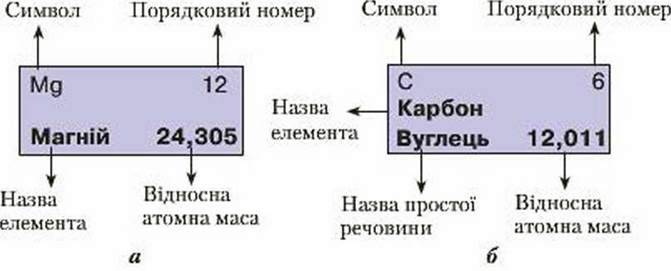
Рис 40. Відомості про елемент у кожній клітинці періодичної системи
Значення періодичної системи. Створення періодичної системи вагомо вплинуло на подальший розвиток усіх природничих наук: хімії, фізики, біології, геології. У хімії, на початку її вивчення, періодична система слугує довідковою таблицею, за якою ви можете з’ясувати:
– символ, назви хімічного елемента і його простої речовини;
– відносну атомну масу потрібного вам елемента;
– кількість протонів у ядрі атома елемента за його порядковим номером;
– кількість нейтронів у ядрі атома елемента, якщо від числового значення відносної атомної маси віднімете числове значення порядкового номера.
З рештою інформації, яку можна дізнатися з періодичної системи, ви поступово ознайомитеся під час вивчення цієї науки.
ПІДСУМОВУЄМО ВИВЧЕНЕ
– Таблиця класифікації хімічних елементів складається з періодів, яких є сім: три малих і чотири великих, і груп, яких нараховується вісім. Групи поділяються на головні й побічні підгрупи.
– Періоди – горизонтальні рядки, у яких із зростанням відносних атомних мас елементів спостерігається зміна металічних властивостей на неметалічні. Починаються вони металічними елементами й закінчуються інертними.
– Групи – вертикальні стовпці хімічних елементів. У групах розташовані подібні за властивостями хімічні елементи.
– Окрема клітинка періодичної системи містить такі відомості: символ і назву хімічного елемента, назву простої речовини, відносну атомну масу, порядковий номер.
– Періодична система – це основа розвитку хімії та інших природничих наук. Уміле користування нею розкриває глибинну суть явищ і процесів, що відбуваються у світі.
ЗАВДАННЯ ДЛЯ КОНТРОЛЮ ЗНАНЬ
1. Назвіть: а) металічні елементи другого-четвертого періодів, їх порядкові номери; б) неметалічні елементи V-VIII груп, їх порядкові номери в періодичній системі.
2. Охарактеризуйте поняття “період”, “група”, “підгрупа”.
3. Укажіть періоди, у яких розташовані елементи з порядковими номерами: а) 13, 14, 15, 16; б) 19, 20, 21, 22. Назвіть ці елементи.
4. Прочитайте символи та вкажіть, у якому випадку назви елементів не збігаються з назвами їх простих речовин: a) Na, Mg, Аl; б) С, N, О; в) Zn, Ga, Ge; г) К, Са, Sc.
5. Напишіть назви елементів, їхні відносні атомні маси й назви простих речовин за порядковими номерами: 4, 6, 8, 16, 29, 30, 32, 47.
6. Визначте й напишіть порядкові номери елементів з відносними атомними масами: 14, 24, 27, 52, 56, 64, 80, 127.
7. Оцініть логіку побудови та значущість періодичної системи.
ЦІКАВО ЗНАТИ
– Гемоглобін крові, який надає їй червоного кольору, і хлорофіл, що надає зеленого забарвлення листкам рослин, дуже близькі за хімічним складом. Відмінність полягає в тому, що гемоглобін містить елемент Ферум, а хлорофіл – Магній.
– Наявність елементів Калію, Нітрогену, Фосфору впливає на врожайність грунтів.