Приклади розв’язування типових задач – Урок 6
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ
6. Суміші речовин. Розчини
Приклади розв’язування типових задач
Задача 1. У розчині, маса якого 400 г, міститься 25 г натрій хлориду. Обчисліть масову частку натрій хлориду (%) в розчині.
Дано:
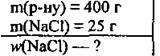
Розв’язання
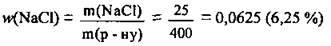
Відповідь: w(NaCl) = 6,25 %.
Задача 2. Натрій гідроксид, маса якого 10 г, розчинили в 120 мл води. Обчисліть масову частку лугу (%) в одержаному розчині.
Дано:
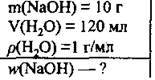
Розв’язання
1. Розрахуємо масу води за формулою 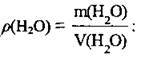
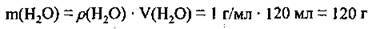
2. Обчислимо масу розчину:
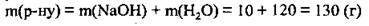
3. Обчислимо масову частку NaOH в одержаному розчині:
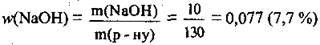
Відповідь: w(NaOH) = 7,7 %.
Задача 3. Обчисліть масу калій хлориду та об’єм води, які потрібно використати для приготування 0,2 кг розчину з масовою часткою солі 0,03.
Дано:
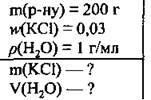
Розв’язання
1. За формулою 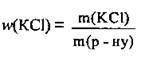 обчислимо масу солі, яка повинна бути в розчині:
обчислимо масу солі, яка повинна бути в розчині:
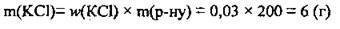
2. Обчислимо
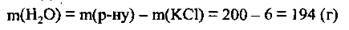
3. За формулою 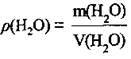 розрахуємо об’єм води:
розрахуємо об’єм води:
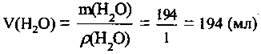
Відповідь: m(КСl) = 6 г; V(H2O) = 194 мл.
Задача 4. Обчисліть масову частку хлороводню (%) в розчині, який одержали доливанням 50 мл води до 200 мл хлоридної кислоти з масовою часткою хлороводню 20 %. Густина цього розчину – 1,098 г/мл.
Дано:
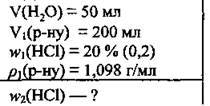
Розв’язання
1. За формулою 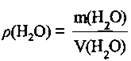 визначимо масу води:
визначимо масу води:
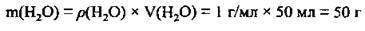
2. За формулою 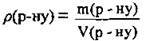 обчислимо масу розчину хлороводню (І):
обчислимо масу розчину хлороводню (І):
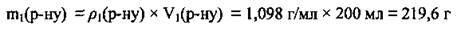
3. За формулою 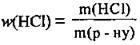 визначимо масу хлороводню в розчині (І):
визначимо масу хлороводню в розчині (І):
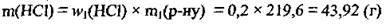
4. Обчислимо масу води:
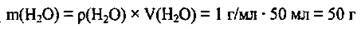
5. Знайдемо масу утвореного (після доливання води) розчину (II):
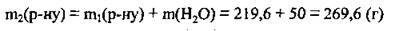
6. За формулою 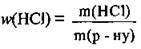 обчислимо масову частку хлороводню в одержаному розчині:
обчислимо масову частку хлороводню в одержаному розчині:
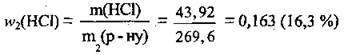
Відповідь: w2(HCl) = 16,3 %.
Задача 5. При частковому випаровуванні 300 г розчину калій хлориду з масовою часткою солі 15% одержали 140,6 г нового розчину. Обчисліть масову частку калій хлориду (%) в ньому.
Дано:
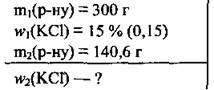
Розв’язання
1. За формулою 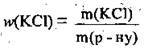 визначимо масу солі у вихідному розчині:
визначимо масу солі у вихідному розчині:
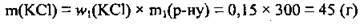
2. Під час випаровування зменшилася маса розчину за рахунок води, яка випаровувалась; маса ж солі залишилася незмінною. За тою ж формулою обчислюємо масову частку солі в новому розчині:
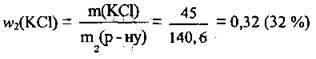
Відповідь: w2(KCl) = 32 %.
Задача 6. У 0,5 л води розчинили 89,6 л хлороводню (н. у.). Обчисліть масову частку хлороводню (%) в одержаній хлоридній кислоті.
Дано:
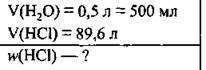
Розв’язання
1. За формулою 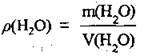 обчислимо масу води, яку використали для приготування розчину ρ(Н2O) = 1 г/мл:
обчислимо масу води, яку використали для приготування розчину ρ(Н2O) = 1 г/мл:
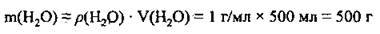
2. Визначимо масу хлороводню. VM = 22,4 л/моль, М(НСl) = 36,5 г/моль:
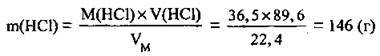
3. Обчислюємо масу одержаного розчину:
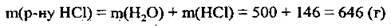
4. Знаходимо масову частку НСl в одержаному розчині:
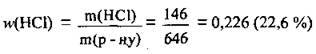
Відповідь: w(HCl) = 22,6 %.
Задача 7. Обчисліть масу ферум(ІІ) сульфату гептагідрату, яку потрібно використати для приготування 228 г розчину з масовою часткою ферум(ІІ) сульфату 0,2.
Дано:
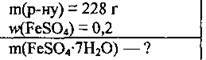
Розв’язання
1. За формулою 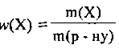 обчислимо масу солі в розчині:
обчислимо масу солі в розчині:
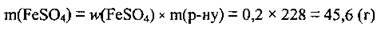
2. Розрахуємо кількість речовини FeSO4. M(FeSO4) =152 г/моль:
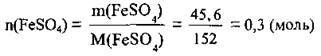
3. Обчислимо кількість речовини ферум(ІІ) сульфату гептагідрату. З хімічної формули кристалогідрату видно, що 1 моль його містить 1 моль ферум(ІІ) сульфату:
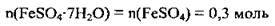
4. Обчислимо масу кристалогідрату кількості речовини 0,3 моль. M(FeSO4 · 7H2O) = 278 г/моль:
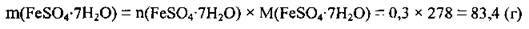
Відповідь: m(FeSO4 · 7H2O) = 83,4 г.
Задача 8. У 120 г розчину купрум(ІІ) сульфату з масовою часткою солі 25 % розчинили 6 г мідного купоросу. Обчисліть масову (%) частку купрум(ІІ) сульфату В одержаному розчині.
Дано:
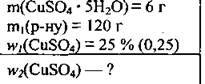
Розв’язання
1. За формулою 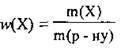 обчислимо масу купрум(ІІ) сульфату в початковому розчині:
обчислимо масу купрум(ІІ) сульфату в початковому розчині:
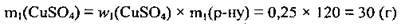
2. Знайдемо кількість речовини мідного купоросу. M(CuS04 · 5Н2O) = 250 г/моль:
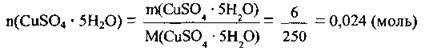
3. Визначимо кількість речовини купрум(II) сульфату в складі мідного купоросу. З формули мідного купоросу CuSO4 · 5Н2O видно, що 1 моль кристалогідрату містить 1 моль CuSO4. Отже,
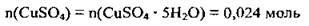
4. Обчислимо масу 0,024 моль купрум(ІІ) сульфату. M(CuSO4) = 160 г/моль:
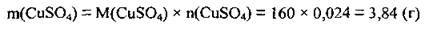
5. Розрахуємо масу одержаного розчину:
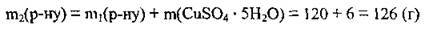
6. Обчислимо масу купрум(ІІ) сульфату в одержаному розчині:
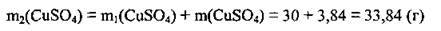
7. Визначимо масову частку солі в одержаному розчині:
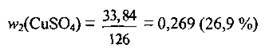
Відповідь: w2(CuSO4) = 26,9 %.
Задача 9. Обчисліть масу натрій сульфату в 400 мл розчину з молярною концентрацією солі 2 моль/л.
Дано:
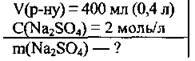
Розв’язання
1. За формулою 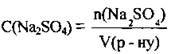 обчислимо кількість речовини солі в розчині:
обчислимо кількість речовини солі в розчині:
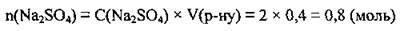
2. За формулою 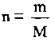 обчислимо масу Na2SO4. M(Na2SO4) = 142 г/моль:
обчислимо масу Na2SO4. M(Na2SO4) = 142 г/моль:
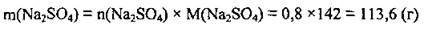
Відповідь: m(Na2S04) = 113,6 г.
Задача 10. Обчисліть молярну концентрацію лугу у 800 мл розчину, який містить 84 г калій гідроксиду.
Дано:
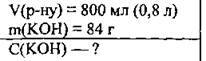
Розв’язання
1. За формулою 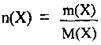 обчислимо кількість речовини лугу в розчині. М(КОН) = 56 г/моль:
обчислимо кількість речовини лугу в розчині. М(КОН) = 56 г/моль:
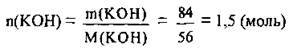
2. Обчислимо молярну концентрацію лугу в розчині:
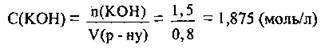
Відповідь: С(КОН) = 1,875 моль/л.
Задача 11. Насичений при 40 °С розчин, маса якого 80 г, містить 10,4 г калій сульфату. Обчисліть: 1) кількість речовини води в розчині; 2) масову частку калій сульфату (%); 3) розчинність солі.
Дано:
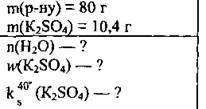
Розв’язання
1. Обчислюємо масу води в розчині:
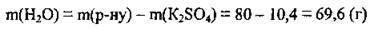
2. Знайдемо кількість речовини води. М(Н2O) = 18 г/моль:
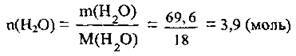
3. Обчислимо масову частку солі в розчині:
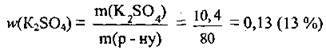
4. Визначимо розчинність солі. Складемо пропорцію:
У 69,9 г Н2O розчиняється 10,4 г K2SO4,
А в 100 г Н2O – х г K2SO4
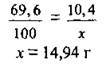
Відповідь: 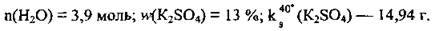
Задача 12. Обчисліть об’єм розчину калій гідроксиду з масовою часткою лугу 10 % (ρ = 1,08 г/мл), необхідний для повної нейтралізації 24,5 г ортофосфатної кислоти.
Дано:
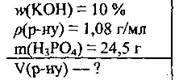
Розв’язання
1. Розрахуємо кількість речовини Н3РO4. М(Н3РO4) = 98 г/моль:
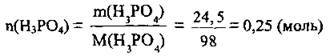
2. Напишемо рівняння хімічної реакції:
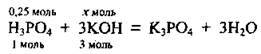
З рівняння випливає така пропорція: 1 моль Н3РO4 відповідає 3 моль КОН, а 0,25 моль Н3РO4 – х моль КОН
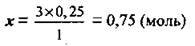
4. За формулою 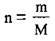 обчислимо масу 0,75 моль КОН. М(КОН) = 56 г/моль:
обчислимо масу 0,75 моль КОН. М(КОН) = 56 г/моль:
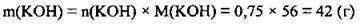
5. За формулою 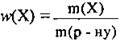 визначимо масу розчину калій гідроксиду:
визначимо масу розчину калій гідроксиду:
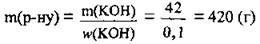
6. За формулою р(р-ну) 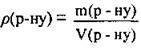 обчислимо об’єм розчину КОН:
обчислимо об’єм розчину КОН:
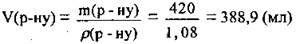
Відповідь: V(р-ну) = 388,9 мл.
Задача 13. Розчинність магній сульфату за температури 85 °С становить 65 г на 100 г води. Визначте масу безводної солі, яку можна одержати при випаровуванні 340 г такого насиченого розчину.
Дано:
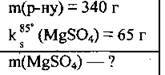
Розв’язання
1. Розчинність магній сульфату при 85 °С становить 65 г на 100 г води. Отже, в кожних 100 г води максимально може розчинитися 65 г солі. Маса цього розчину становить:
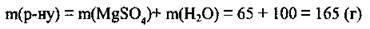
2. Складемо пропорцію: 165 г розчину містить 65 г MgSO4, а 340 г розчину – х г MgSO4.
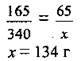
Відповідь: m(MgSO4) = 134 г.