РЕАКЦІЇ В РОЗЧИНАХ ЕЛЕКТРОЛІТІВ – ЕЛЕКТРОЛІТИ
Хімія – універсальний довідник
ЕЛЕКТРОЛІТИ
РЕАКЦІЇ В РОЗЧИНАХ ЕЛЕКТРОЛІТІВ
У розчинах електролітів у хімічну взаємодію вступають іони. З’ясуємо, у яких випадках це відбувається.
Якщо змішати водні розчини кухонної солі (хлориду натрію) і вапняної води (розчину гідроксиду кальцію), то зовнішніх змін не спостерігається. Формально можна написати
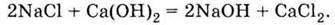
З огляду на те, що всі чотири речовини (хлорид і гідроксид натрію, хлорид і гідроксид кальцію) – вільні електроліти, запишемо рівняння реакції в
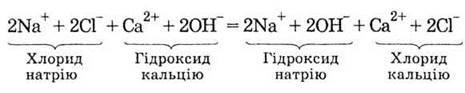
Чим ліва частина цього рівняння відрізняється від правої? Нічим, крім порядку написання формул. Вихідна суміш іонів не змінилася. Ніякої хімічної реакції не відбулося.
Якщо хлорид натрію замінити на карбонат натрію, то при змішуванні їх розчинів випадає осад, відбувається реакція. В іонному вигляді її рівняння можна записати так:
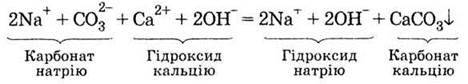
Якщо не вказувати іони, які не взяли участі в реакції (це іони Nа+ і ОН-), то одержимо запис, який називається скороченим іонним рівнянням реакції:
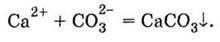
Скорочене іонне рівняння відображає,
Ця реакція відбувається тому, що іони, які з’єднуються, утворюють малорозчинну речовину, яка випадає у вигляді осаду, тобто виходить зі сфери реакції. Це перший приклад необоротної реакції в розчині електроліту.
Інший приклад – взаємодія карбонату натрію із хлоридною кислотою. Запишемо рівняння електролітичної дисоціації взятих речовин:
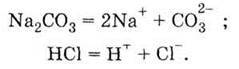
У цьому розчині варто брати до уваги можливість взаємодії лише різнойменно заряджених іонів. Іони Nа+ не можуть взаємодіяти з іонами Сl-, тому що можлива сполука NаСl – сіль, яка є сильним електролітом і в розчині існує тільки у вигляді окремих іонів Nа+ і Сl-. Можуть взаємодіяти іони СО32- і Н+ з утворенням слабкої (тобто малодисоційованої) карбонатної кислоти:
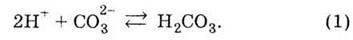
Карбонатна кислота – дуже нестійка сполука і практично миттєво розкладається на воду і кислотний оксид:
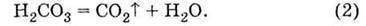
Діоксид карбону – вуглекислий газ залишає сферу реакції. При додаванні рівнянь (1) і (2) одержуємо сумарний запис рівняння реакції карбонат-іонів з іонами Гідрогену:
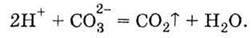
Газ, який залишає сферу реакції, не може вступити у зворотну реакцію, отже, це необоротна реакція. Таким чином, реакція карбонату натрію з хлоридною кислотою може бути подана молекулярним рівнянням
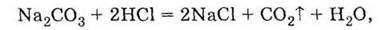
Повним іонним рівнянням
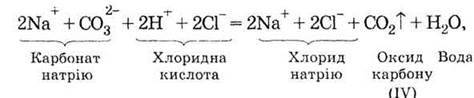
Скороченим іонним рівнянням
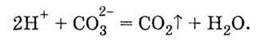
Останнє рівняння, як і всі скорочені іонні рівняння, відображає суть розглянутої хімічної реакції: незалежно від речовини, яка містить карбонат-іони, і кислоти під час їх взаємодії завжди буде виділятися вуглекислий газ і утворюватися вода. (Однак кислота повинна бути не слабшою карбонатної, тобто містити у своєму розчині більше іонів Гідрогену, ніж карбонатна.)
Таким чином, говорячи про хімізм процесу, варто користуватися скороченим іонним рівнянням реакції. Водночас у процесі розрахунків кількостей речовин, які вступили в реакцію й утворилися, необхідний запис у молекулярній формі.
Вода та інші слабкі електроліти в іонних рівняннях реакцій, зазвичай, записуються у молекулярному вигляді і лише в окремих випадках – в іонному.
Отже, якщо в результаті реакції утвориться вода, то зі сфери реакції виходять деякі учасники реакції, а саме іони Н+ і ОН-, а це, власне, і є необхідною умовою необоротності хімічної взаємодії.
Це ще один приклад необоротних реакцій – реакції нейтралізації, тобто взаємодії між кислотами й основами. Іонне рівняння реакції, яка відбувається, необхідно записати так:
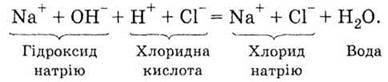
З розчину зникають іони Н+ і ОН-, як це видно зі скороченого іонного рівняння:
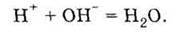
Отже, щоб у розчині електроліту відбулася реакція (а вона відбувається за участю іонів), необхідно, щоб хоч деякі іони вийшли зі сфери реакції. Це реалізується при випаданні осаду, виділенні газу, утворенні слабкого електроліту (дуже часто води).