Ряд стандартних електродних потенціалів – ЗАГАЛЬНІ ВЛАСТИВОСТІ МЕТАЛІВ
ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Частина II. НЕОРГАНІЧНА ХІМІЯ
Розділ 12. ЗАГАЛЬНІ ВЛАСТИВОСТІ МЕТАЛІВ
§ 12.5. Ряд стандартних електродних потенціалів
У середній школі ви вивчаєте електрохімічний ряд напруг металів. Більш точна назва його – ряд стандартних електродних потенціалів металів. Для деяких металів він наведений у табл. 12.1. Як же складається такий ряд? Чому, наприклад, натрій стоїть у ньому після кальцію? Як цим рядом користуватися?
Відповідь на перше запитання можна дати на основі вже
Безпосередньо виміряти потенціал окремого електрода неможливо. Тому електродні потенціали вимірюють відносно стандартного водневого електрода, потенціал якого умовно приймають за нуль при всіх значеннях температури. Водневий електрод складається з платино-
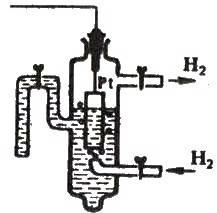
Рис. 12.3. Стандартний
Вої пластинки, покритої платиновою черню (електролітично осадженою платиною), яка занурена у розчин сульфатної кислоти з концентрацією іонів гідрогену, що дорівнює 1 моль/л, і омивається струменем газуватого водню під тиском 101,325 кПа при 25°С (рис. 12.3).
Молекулярний водень, проходячи крізь розчин, розчиняється і підходить до поверхні платини. На поверхні платини відбувається розщеплення молекул водню на атоми та їх адсорбція (закріплення на поверхні). Адсорбовані атоми гідрогену Надс іонізуються:
Надс – e – -> Н+ ,
А іони гідрогену, приєднуючи електрони, переходять в адсорбований стан:
Н+ +e – -> Надс.
Повніше рівновага у водневому електроді виражається схемою:
2Н+ + 2е – ⇆ 2Haдс(Pt) = Н2.
Середню частину цієї рівноваги звичайно опускають, хоча слід мати на увазі, яку велику роль у встановленні такого рівноважного стану відіграє платина.
Якщо тепер пластинку будь-якого металу, зануреного в розчин його солі з концентрацією іонів металу 1 моль/л, з’єднати зі стандартним водневим електродом, як показано на рис. 12.4, то утвориться гальванічний елемент (електрохімічний ланцюг), електрорушійну силу (скорочено ЕРС) якого легко виміряти. Ця ЕРС і називається стандартним електродним потенціалом даного електрода (звичайно позначається Е°). Отже, електродним потенціалом називають ЕРС гальванічного елемента (електрохімічного ланцюга), яка складається з
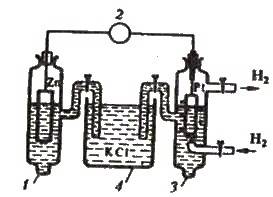
Рис. 12.4. Гальванічний ланцюг для вимірювання стандартного електродного потенціалу металу:
1 – вимірюваний електрод;
2 – потенціометр;
3 – стандартний водневий електрод;
4 – розчин хлориду калію
Досліджуваного електрода і стандартного водневого електрода.
Такий ланцюг зображено на рис. 12.4. Електродний потенціал називають також окисно-відновним потенціалом.
При позначенні електродних потенціалів Е і стандартних електродних потенціалів Е° прийнято біля знаків ставити індекс, що відповідає системі, до якої належить даний потенціал. Так, стандартний електродний потенціал системи 2Н+ + 2е – ⇆ Н2 позначають Е°2Н+/Н2, системи Li+ + е – ⇆ Li – E°Li+/Li, а системи МnO-4 + 8Н+ + 5е – ⇆ Mn2+ + 4Н2О пишуть Е°МnО-4 + 8Н+/Mn2++ 4Н2O.
Розміщуючи метали у порядку зростання алгебраїчного значення їх стандартних електродних потенціалів, одержують ряд, представлений у табл. 12.1. До нього можуть бути включені й інші окисно-відновні системи (в тому числі неметалічні) відповідно до значень їх Е°, наприклад E° C l2/С l – = 1,36 В, Е°F2/2F – = 2,87 В, Е°S/S2- = -0,51 В і т. д. Ряд, представлений у табл. 12.1, можна розглядати лише як фрагмент з ряду стандартних електродних потенціалів окисно-відновних систем у водних розчинах при 25°С, складений з найважливіших металів1. Історично цьому ряду передував “витискуючий ряд” М. М. Бекетова.
Символ Нg застосовується до ртутного електрода, що занурений у розчин солі гідраргіруму (І), іон якого прийнято зображати у вигляді димера:
Нg2+2 + 2е – = 2Нg.
Більшість стандартних електродних потенціалів можна визначити експериментально. Проте для лужних та лужноземельних металів значення Е° розраховують тільки теоретично, оскільки ці метали взаємодіють з водою.
Ряд стандартних електродних потенціалів характеризує хімічні властивості металів. Його застосовують для з’ясування, в якій послідовності відновлюються іони під час електролізу (§ 7.7), а також для опису інших властивостей металів (§ 10.9 та 12.5).
1 У США прийнято протилежні знаки електродних потенціалів: найбільш позитивний (+3,04 В) у електрода Li+/Li і найбільш негативний (-2,87 В) у системи F2/2F-. Такий порядок відліку можна побачити і в американській навчальній літературі, перекладеній російською мовою.
Чим менше алгебраїчне значення потенціалу, тим вища відновна здатність цього металу і тим нижча окисна здатність його іонів.
Як випливає з цього ряду, металічний літій – найсильніший відновник, а золото – найслабший. І навпаки, іон золота Au – найсильніший окисник, а іон літію Li+ – найслабший (у табл. 12.1 зростання цих властивостей вказано стрілками).
Кожний метал в ряду стандартних електродних потенціалів має властивість витісняти всі наступні метали з розчинів їх солей. Проте це не означає, що витіснення буде обов’язково відбуватися у всіх випадках. Так, алюміній витісняє мідь з розчину хлориду купруму(ІІ) СиСl2, але практично не витісняє її з розчину сульфату купруму(ІІ) CuSO4. Це пояснюється тим, що хлорид-іони Сl – значно швидше руйнують захисну поверхневу плівку на алюмінії порівняно із сульфат-іонами SO2-.
Дуже часто на основі ряду стандартних електродних потенціалів пишуть рівняння реакцій витіснення металів з розчинів їх солей більш активними лужними та лужноземельними металами і, природно, помиляються. У цьому випадку витіснення металів не відбувається, тому що лужні та лужноземельні метали самі реагують з водою.
Всі метали, що мають від’ємні значення стандартних електродних потенціалів, тобто які стоять в ряду до водню, витісняють водень з розведених кислот (типу НСl або H2SO4) і при цьому розчиняються в них. Однак свинець в розведених розчинах сульфатної кислоти практично не розчиняється. Відбувається це тому, що на поверхні свинцю відразу утворюється захисний шар з малорозчинної солі сульфату плюмбуму PbSO4, який порушує контакт розчину з металом. Метали, що стоять в ряду після водню, не витісняють його з кислот.
З наведених прикладів можна зробити висновок, що рядом стандартних електродних потенціалів слід користуватися з урахуванням особливостей розглянутих процесів. Найголовніше – треба мати на увазі, що ряд стандартних електродних потенціалів можна застосовувати тільки для водних розчинів і що він характеризує хімічну активність металів лише в окисно-відновних реакціях, які відбуваються у водному середовищі.
Натрій у ряду стандартних електродних потенціалів розташований після кальцію Са: у нього більше алгебраїчне значення стандартного електродного потенціалу.
ЕРС будь-якого гальванічного елемента можна обчислити за різницею стандартних електродних потенціалів Е°. При цьому слід мати на увазі, що ЕРС – завжди додатна величина. Тому від потенціалу електрода, що має більше алгебраїчне значення, потрібно відняти потенціал електрода, алгебраїчне значення якого менше. Наприклад, ЕРС мідно-цинкового елемента за стандартних умов становитиме 0,34 – (-0,76) = 1,1 В.