Швидкість хімічної реакції – Приклади розв’язування типових задач – Урок 5 – Хімічна реакція
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ
4. Хімічна реакція
Приклади розв’язування типових задач
І. Швидкість хімічної реакції
Формули і поняття, які використовуються:
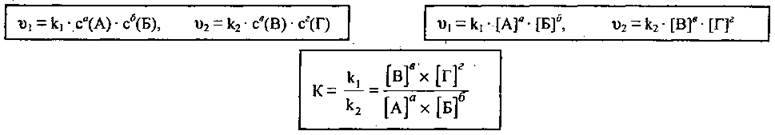
Де v1 – швидкість прямої реакції,
V2 – швидкість зворотної реакції,
A, Б – реагенти реакції,
B, Г – продукти реакції,
С(А), с(Б) – концентрації реагентів,
С(В), с(Г) – концентрації продуктів реакції,
, , , – рівноважні концентрації речовин
А, б, в, г – стехіометричні коефіцієнти,
K1, k2 – константи швидкостей прямої та зворотної реакцій,
К – константа рівноваги.
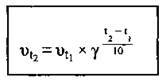
Де vt2 – швидкість реакції за температури t2,
Vt1 – швидкість реакції за температури t1,
Γ – температурний коефіцієнт (γ = 2…4).
Т (“тау”) – тривалість реакції, с.
Задача 1. Як зміниться швидкість реакції, температурний коефіцієнт якої 2, при підвищенні температури з 10 до 40 °С?
Розв’язання
З формули
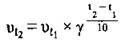
Можна обчислити, у скільки разів зміниться швидкість реакції:
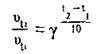
Підставимо значення в цю формулу і проведемо обчислення:
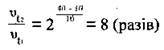
Відповідь: швидкість реакції збільшиться у 8 разів.
Задача 2. Визначте температурний коефіцієнт реакції, якщо при підвищенні температури з 20 до 60 °С її швидкість збільшилась у 256 разів.
Розв’язання
У формулу
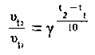
Підставляємо відомі значення:
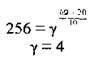
Відповідь: температурний коефіцієнт реакції становить 4.
Задача 3. При 30 °С реакція відбувається за 3 хвилини. Скільки часу буде відбуватися ця реакція при 60 °С? Температурний коефіцієнт становить 3.
Дано:
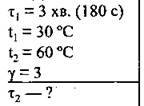
Розв’язання
1. З формули, яка випливає з правила Вант-Гоффа 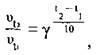 розрахуємо, у скільки разів зросте швидкість реакції при підвищенні температури від 30 до 60 °С:
розрахуємо, у скільки разів зросте швидкість реакції при підвищенні температури від 30 до 60 °С:
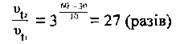
2. Отже, швидкість зросте у 27 разів, а час реакції (т2) відповідно зменшиться у стільки ж разів:
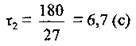
Відповідь: реакція завершиться за 6,7 с.
Задача 4. Як зміниться швидкість прямої реакції 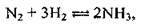 якщо об’єм газової суміші зменшити у 3 рази?
якщо об’єм газової суміші зменшити у 3 рази?
Дано:
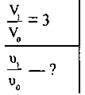
Розв’язання
1. Якщо припустити, що початкові концентрації азоту і водню (с0) відповідно становлять а моль/л і b моль/л, то кінетичне рівняння для визначення швидкості прямої реакції буде таким:
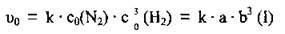
2. Зменшення об’єму газової суміші в 3 рази приведе до підвищення концентрації реагентів також у 3 рази: c1(N2) = 3а моль/л, а с1(Н2) = 3b моль/л. Кінетичне рівняння:
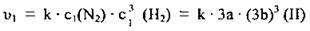
3. Для того щоб розрахувати, у скільки разів швидкість прямої реакції змінилась, поділимо вираз для швидкості після зменшення об’єму суміші (II) на вираз для початкової швидкості (І):
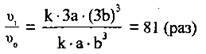
Відповідь: швидкість прямої реакції збільшиться у 81 раз.
Задача 5. Як зміниться швидкість прямої реакції 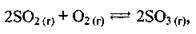 якщо тиск у системі підвищити в 3 рази?
якщо тиск у системі підвищити в 3 рази?
Дано:
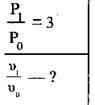
Розв’язання
1. Припустимо, що початкові концентрації SO2 і O2 становлять відповідно а моль/л і b моль/л. Тоді кінетичне рівняння для визначення швидкості прямої реакції становитиме:
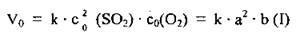
2. Підвищення тиску в 3 рази приведе до підвищення концентрації регентів у стільки ж разів: c1(SO2) = 3а моль/л, а c1(O2) = 3b моль/л. Кінетичне рівняння:
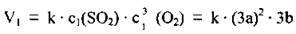
3. Для того щоб розрахувати, у скільки разів швидкість прямої реакції змінилась, поділимо вираз для швидкості після підвищення тиску суміші (II) на вираз для початкової швидкості (І):
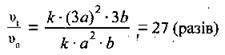
Відповідь: швидкість прямої реакції збільшиться у 27 разів.
Задача 6. У скільки разів потрібно підвищити тиск, щоб швидкість реакції утворення нітроген(ІV) оксиду відповідно до реакції 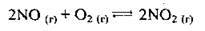 збільшилась у 1000 разів?
збільшилась у 1000 разів?
Дано:
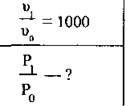
Розв’язання
1. Припустимо, що початкові концентрації NO і O2 становлять відповідно а моль/л і b моль/л. Тоді кінетичне рівняння для визначення швидкості прямої реакції становитиме:
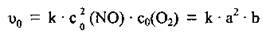
2. Підвищення тиску в системі приводить до відповідного зменшення об’єму і підвищення концентрації реагентів (у таку ж кількість разів). Отже, припустивши, що тиск підвищили в xразів, одержимо:
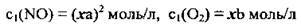
Тоді кінетичне рівняння для швидкості реакції після підвищення тиску матиме такий вигляд:
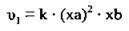
3. Ураховуючи, що 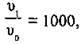 одержимо:
одержимо:
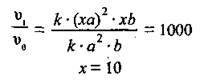
Відповідь: тиск треба підвищити в 10 разів.