Силіцій
РОЗДІЛ 2 НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ
ХІМІЧНІ ЕЛЕМЕНТИ IVA ГРУПИ
§ 50. Силіцій
Усвідомлення змісту цього параграфа дає змогу:
Характеризувати алотропні видозміни Силіцію, їх фізичні та хімічні властивості, способи добування, застосування; складати рівняння, схеми електронного балансу відповідних хімічних реакцій.
Алотропні видозміни Силіцію. Фізичні властивості. Силіцій утворює дві прості речовини, тобто дві алотропні видозміни: силіцій кристалічний і силіцій аморфний, які різняться будовою речовини (мал. 83).
Кристалічний
Аморфний силіцій має також кристалічну гратку, подібну до алмазу, але невпорядковану. Це бурий порошок, без певної температури плавлення, що характерно для аморфних речовин.
Добування. У природі Силіцій у вільному стані не трапляється, існує лише у вигляді сполук. Поширеними природними сполуками є силіцій(ІУ) оксид і силікати зі ступенем окиснення Силіцію +4. Тому для його добування використовують окисно-відновні реакції, в яких відбувається відновлення Силіцію за схемою: 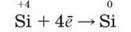


Мал. 83. Силіцій: а – кристалічний; б – аморфний
Найбільш доступною й дешевою сировиною для добування силіцію є пісок SiO2 У промисловості силіцій добувають нагріванням суміші піску і вугілля:
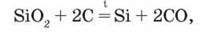
А в лабораторії – взаємодією чистого піску з порошком магнію:
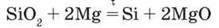
– Складіть схеми електронного балансу розглянутих реакцій.
Хімічні властивості. За хімічними властивостями силіцій, як і вуглець, є неметалом. Однак його неметалічні властивості менш виявлені, оскільки радіус атома більший і зовнішні електрони розміщені далі від ядра (див. § 44, табл. 13). Кристалічний силіцій за стандартних умов хімічно доволі інертний, але при нагріванні стає активнішим. Аморфний – значно активніший, ніж кристалічний. Усі реакції за участю силіцію є окисно-відновними. В них силіцій, подібно до вуглецю, виявляє відновні або окиснювальні властивості.
Відновні властивості більш характерні для силіцію і відповідають
Процесу:
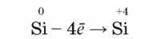
За стандартних умов силіцій реагує з фтором, при нагріванні сполучається з іншими галогенами, киснем, азотом, сіркою, вуглецем:
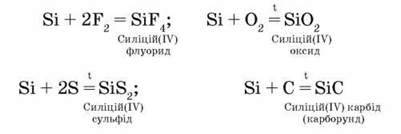
З кислотами не реагує. У реакції з розчином або розплавом лугу силіцій так само, як алюміній, витісняє водень:
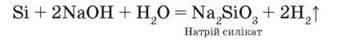
Окиснювальні властивості силіцію відповідають процесу:
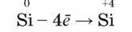 І виявляються при нагріванні в реакціях з багатьма металами (Ca, Cu, Cr, Mg, Mn, Fe та ін.):
І виявляються при нагріванні в реакціях з багатьма металами (Ca, Cu, Cr, Mg, Mn, Fe та ін.):
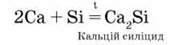
– Складіть схеми електронного балансу для розглянутих реакцій. Доведіть окисно-відновні властивості силіцію. Застосування. Силіцій застосовується для добування різних сплавів. Так, залізо із 4 %-вою добавкою силіцію має здатність швидко намагнічуватися і розмагнічуватися. З нього виробляють електричні трансформатори. Сталь із вмістом 15 – 20 % силіцію є кислотостійкою, її застосовують для виготовлення хімічної апаратури. Сплав міді з 4 – 5 % силіцію застосовується в машинобудуванні.
Кристали силіцію є напівпровідниками, і тому мають широке застосування в мікроелектроніці. На світлі провідна здатність силіцію зростає. Якщо з’єднати два кристали силіцію, один з яких розміщений на світлі, а інший – у темряві, то виникає електричний струм. Це явище використовується у фотоелементах – пристроях, які перетворюють сонячну енергію в електричну. Фотоелементи використовують у годинниках і мікрокалькуляторах. Тисячі кристалів силіцію, об’єднаних у сонячну батарею, є джерелом електричної енергії і на Землі, і в Космосі, наприклад на штучних супутниках. Із силіцію добувають карборунд, який за твердістю поступається лише алмазу. Тому його використовують для заточування різців металорізальних верстатів і шліфування коштовних каменів (див. мал. 76).
Коротко про головне
Силіцій належить до неметалів. У природі у вільному стані не трапляється, існує у вигляді двох алотропних видозмін – це силіцій кристалічний і силіцій аморфний, які різняться за будовою речовини.
Кристалічний силіцій має алмазоподібну кристалічну гратку. Аморфний силіцій має також алмазоподібну кристалічну гратку, але невпорядковану.
У хімічних реакціях силіцій хімічно інертний, реагує переважно за високих температур, виявляє відновні (найбільш характерні) й окиснювальні властивості. Сировиною для добування силіцію є пісок. Має широке застосування в мікроелектроніці, сонячній енергетиці, металургії.
Для допитливих. У Каліфорнії (США) є Силіконова долина, де зосереджені відомі в усьому світі компанії з виробництва комп’ютерів, пристроїв мобільного зв’язку, програмного забезпечення, біотехнології тощо. Назва Силіконова долина є уособленням надсучасних технологій і високого рівня життя.