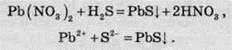Сірководень – ОКСИГЕН. СУЛЬФУР
Хімія підготовка до ЗНО та ДПА
Комплексне видання
ЧАСТИНА І
ЗАГАЛЬНА ХІМІЯ
ХІМІЯ ЕЛЕМЕНТІВ
ОКСИГЕН. СУЛЬФУР
Сірководень
Молекула сірководню складається з атома Сульфуру та двох атомів Гідрогену, сполучених полярним ковалентним зв’язком. Кут між зв’язками SH дорівнює 91°. Молекула сірководню полярна.
Сірководень – природний компонент вулканічних і природних газів. Деякі мінеральні води містять розчинений сірководень, що надає їм лікувальних властивостей. Сірководень утворюється в результаті гниття
Фізичні властивості сірководню
Сірководень – безбарвний газ із запахом тухлих яєць. В 1 об’ємі води розчиняється 3 об’єми сірководню, при цьому утворюється приблизно 0,1 молярний розчин. Температура плавлення сірководню дорівнює -83 °С, а температура кипіння -61 °С. Сірководень впливає на нервову систему людини, тому працювати з ним необхідно під витяжною шафою.
Хімічні властивості сірководню
Сірководень є сполукою, що має будову, подібну до молекули води, проте порівняно
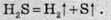
Горіння може відбуватися за двома різними напрямами. У надлишку кисню утворюється вода та сульфур(ІV) оксид:
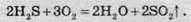
За нестачі кисню відбувається неповне згорання сірководню. Цей процес використовується для добування сірки в промислових масштабах з газів, які утворюються під час випалювання руд:
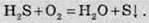
Бром і йод відновлюють сірководень до простої речовини сірки:
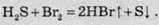
Сірководень за підвищених температур реагує з гексафторсульфуром:
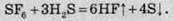
У разі розчинення сірководню у воді утворюється слабка двохосновна сульфідна кислота (Кa1 = 10-7, Кa2 = 1,2 ∙ 10-13):
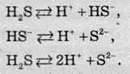
Середні солі сульфідної кислоти називаються сульфідами (наприклад, K2S – це калій сульфід). Відомі також кислі солі відповідної кислоти – гідрогенсульфіди (KHS – калій гідрогенсульфід). Оскільки сульфідна кислота є доволі слабкою кислотою, то розчини сульфідів і гідрогенсульфідів піддаються гідролізу по аніону, і відповідно середовище розчину основне:
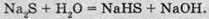
Сульфіди лужних і лужноземельних металів розчинні у воді, а інші сульфіди не розчинні. Багато солей сульфідної кислоти мають характерне забарвлення: HgS – червоне, Sb2S3 – оранжеве, CdS – жовте, MnS – рожеве, CuS – чорне.
Добування та застосування сірководню
Сірководень зазвичай добувають дією мінеральних кислот на сульфіди металів:
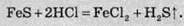
Сірководень також можна добути і з простих речовин.
Застосовують сірководень у якісному аналізі катіонів за сульфідною класифікацією. Також він відіграє важливу роль у процесі виробництва сульфатної кислоти.
Якісна реакція на сірководень i сульфід-іон
Для визначення сульфід-іонів у розчині до досліджуваного розчину додають будь-яку розчинну сіль Плюмбуму (найчастіше ацетат Рb(СН3СОО)2 або нітрат Pb(NO3)2). Якщо після додавання у розчині з’являється чорний осад, то в досліджуваному зразку були присутні сульфід-іони: