Головна ⇒ 📌Довідник з хімії ⇒ СОЛІ ЯК ЕЛЕКТРОЛІТИ – ЕЛЕКТРОЛІТИ
СОЛІ ЯК ЕЛЕКТРОЛІТИ – ЕЛЕКТРОЛІТИ
Хімія – універсальний довідник
ЕЛЕКТРОЛІТИ
СОЛІ ЯК ЕЛЕКТРОЛІТИ
При розчиненні у воді солі дисоціюють з утворенням позитивно заряджених іонів металу (або амонію NН4+) і негативно заряджених кислотних залишків. Ці іони і визначають поведінку солей у розчинах.
Солі можуть взаємодіяти з кислотами:
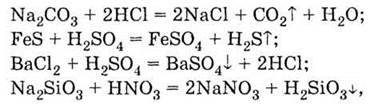
З лугами:
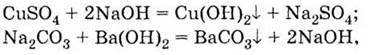
З іншими солями:
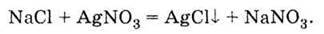
І тут, як і в усіх реакціях, які відбуваються в розчинах електролітів, необхідною умовою протікання реакції є видалення хоча б деяких іонів із розчину.
Related posts:
- КИСЛОТИ ЯК ЕЛЕКТРОЛІТИ – ЕЛЕКТРОЛІТИ Хімія – універсальний довідник ЕЛЕКТРОЛІТИ КИСЛОТИ ЯК ЕЛЕКТРОЛІТИ Властивості кислот можуть бути поділені на три групи. Перша група об’єднує загальні властивості кислот, зумовлені наявністю в їхніх розчинах іонів Гідрогену. Це – зміна забарвлення індикаторів, смак, взаємодія з металами, які стоять в ряді напруг металів лівіше Гідрогену, з основними оксидами, лугами, основами. Наведемо відповідні скорочені іонні […]...
- СИЛЬНІ І СЛАБКІ ЕЛЕКТРОЛІТИ – ЕЛЕКТРОЛІТИ Хімія – універсальний довідник ЕЛЕКТРОЛІТИ СИЛЬНІ І СЛАБКІ ЕЛЕКТРОЛІТИ Якщо реакція речовини з водою, яка призводить до утворення іонів, не проходить до кінця і у розчині залишаються молекули вихідної речовини, тобто процес електролітичної дисоціації оборотний, то така речовина належить до слабких електролітів. Крім описаних у попередньому параграфі води й аміаку, до слабких електролітів належать майже […]...
- Сильні й слабкі електроліти – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.10. Сильні й слабкі електроліти Розрізняють сильні й слабкі електроліти. Сильні електроліти під час розчинення у воді повністю дисоціюють на іони. До них належать: 1) майже всі солі; 2) багато мінеральних кислот, наприклад H2SO4, HNO3, […]...
- ОСНОВИ ЯК ЕЛЕКТРОЛІТИ – ЕЛЕКТРОЛІТИ Хімія – універсальний довідник ЕЛЕКТРОЛІТИ ОСНОВИ ЯК ЕЛЕКТРОЛІТИ Існує дві групи основ: розчинні у воді луги і нерозчинні. Луги є сильними електролітами, в їх розчинах молекул гідроксидів немає. Нерозчинні основи (насправді практично нерозчинні) – слабкі електроліти. Слабким електролітом є гідроксид амонію NH4ОН, який існує тільки у розчині і є сполукою молекули аміаку з молекулою води […]...
- Солі амонію РОЗДІЛ 2 НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ ХІМІЧНІ ЕЛЕМЕНТИ VA ГРУПИ § 33. Солі амонію Усвідомлення змісту цього параграфа дає змогу: Характеризувати фізичні, загальні та специфічні хімічні властивості солей амонію, їх добування і застосування; експериментально розпізнавати солі амонію; Складати рівняння та схеми електронного балансу відповідних хімічних реакцій. Солі амонію мають йонну кристалічну гратку, у вузлах […]...
- ЕЛЕКТРОЛІТИ І НЕЕЛЕКТРОЛІТИ – ЕЛЕКТРОЛІТИ Хімія – універсальний довідник ЕЛЕКТРОЛІТИ ЕЛЕКТРОЛІТИ І НЕЕЛЕКТРОЛІТИ Речовини, які мають іонну електропровідність, називаються електролітами. Усі інші речовини називаються неелектролітами. Електроліти – складні речовини, що складаються з іонів – позитивних і негативних, причому ці іони повинні володіти здатністю до переміщення в речовині. Таким чином, для того, щоб розпізнати, чи є дана рідина-неметал (тверда, рідка, розчин) […]...
- РЕАКЦІЇ В РОЗЧИНАХ ЕЛЕКТРОЛІТІВ – ЕЛЕКТРОЛІТИ Хімія – універсальний довідник ЕЛЕКТРОЛІТИ РЕАКЦІЇ В РОЗЧИНАХ ЕЛЕКТРОЛІТІВ У розчинах електролітів у хімічну взаємодію вступають іони. З’ясуємо, у яких випадках це відбувається. Якщо змішати водні розчини кухонної солі (хлориду натрію) і вапняної води (розчину гідроксиду кальцію), то зовнішніх змін не спостерігається. Формально можна написати З огляду на те, що всі чотири речовини (хлорид і […]...
- Солі амонію – Елементи VA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.4. Елементи VA групи 9.4.4. Солі амонію Солі амонію містять у своєму складі складний катіон NH4+. Це кристалічні речовини з йонним типом зв’язку, мають йонні кристалічні гратки, у вузлах яких розміщуються катіони (NH4+) та аніони (кислотні […]...
- Електроліти і неелектроліти – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.4. Електроліти і неелектроліти Добре відомо, що одні речовини в розчиненому або розплавленому вигляді проводять електричний струм, інші за таких самих умов струм не проводять. Це можна простежити за допомогою простого приладу (рис. 5.4). Він […]...
- ОБОРОТНІ РЕАКЦІЇ – ЕЛЕКТРОЛІТИ Хімія – універсальний довідник ЕЛЕКТРОЛІТИ ОБОРОТНІ РЕАКЦІЇ Реакція дисоціації води, рівняння якої наведено у попередньому параграфі, протікає незначною мірою. З кожного мільярда молекул води в ній беруть участь лише дві, тому концентрація кожного з іонів, які утворюються, мізерно мала (10-7 моль/л). Коли кажуть, що вода – слабкий електроліт, то мають на увазі, що вона слабко […]...
- Ступінь дисоціації. Сильні та слабкі електроліти Тема 1 РОЗЧИНИ Урок 13 Тема уроку. Ступінь дисоціації. Сильні та слабкі електроліти Цілі уроку: розширити знання учнів про електроліти; ознайомити з поняттями “сильні та слабкі електроліти”; показати кількісну характеристику процесу електролітичної дисоціації – ступінь дисоціації; закріпити навички складання рівнянь дисоціації кислот, основ і солей; визначити відмінності сильних і слабких електролітів. Тип уроку: комбінований урок […]...
- Сильні та слабкі електроліти – ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ Сильні та слабкі електроліти Усі електроліти поділяють на сильні та слабкі. Сильні електроліти в розчинах дисоціюють повністю, а слабкі – частково, тобто частина молекул залишається в недисоційованому стані. До сильних електролітів відносять усі солі (за незначним винятком), луги (гідроксиди лужних металів, […]...
- Солі – НАЙВАЖЛИВІШІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 6. НАЙВАЖЛИВІШІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК § 6.4. Солі Визначення класу солей див. § 5.8. Рівняння їх дисоціації із урахуванням гідратації іонів слід записувати так: NaCl (к.) ⇆Na+ (водн.) + Сl – (водн.); К3РО4 (к.) ЗК+ (водн.) + РО3-4 (водн.). Залежно від […]...
- Солі амонію – ПІДГРУПА НІТРОГЕНУ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 10. ПІДГРУПА НІТРОГЕНУ § 10.5. Солі амонію Солі амонію та їх властивості. Солі амонію складаються з катіона амонію та аніона кислоти. За будовою вони аналогічні відповідним солям однозарядних іонів металів. Солі амонію добувають при взаємодії аміаку або його водних розчинів з […]...
- Амфотерні гідроксиди – Амфотерні сполуки – Основні класи неорганічних сполук ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 7. Основні класи неорганічних сполук 7.5. Амфотерні сполуки 7.5.2. Амфотерні гідроксиди Амфотерні гідроксиди – це гідрати амфотерних оксидів, яким притаманні слабкі основні властивості, а також слабкі кислотні властивості. Усі амфотерні гідроксиди – це білі тверді речовини, які не розчиняються у воді: – Zn(OH)2 […]...
- Солі Алюмінію – Алюміній ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.4. Алюміній 8.4.3. Солі Алюмінію Алюміній утворює солі всіх типів з відомими неорганічними кислотами. Зазначимо, що йон Аl3+ здатний до комплексоутворення завдяки великому заряду та наявності вакантних орбіталей: Середні Кислі Основні Подвійні (галуни) Комплексні АlСl3, Al2(SO4)3 […]...
- СУЛЬФАТНА КИСЛОТА ТА ЇЇ СОЛІ – ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ Хімія – універсальний довідник ХІМІЯ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ СУЛЬФАТНА КИСЛОТА ТА ЇЇ СОЛІ У творений при окисненні діоксиду сульфуру триоксид сульфуру – кислотний оксид. Під час його взаємодії з водою утворюється сульфатна кислота Н2SO4: Безводна сульфатна кислота – рідина, густина якої майже у два рази перевищує густину води. Вона змішується з водою у будь-яких пропорціях. Процес […]...
- Солі ортофосфатної кислоти – Елементи VA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.4. Елементи VA групи 9.4.12. Солі ортофосфатної кислоти Як трьохосновна кислота Н3РO4 утворює три ряди солей: 1) середні (нормальні): К3РО4 – калій ортофосфат, Mg3(PO4)2-магній ортофосфат; І кислі: 2) однозаміщені: КН2РO4 – калій дигідрогенфосфат, Са(Н2РO4)2 – кальцій […]...
- Сульфітна кислота та її солі – Елементи VIA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.3. Елементи VIA Групи 9.3.9. Сульфітна кислота та її солі Сульфітна кислота Н2SO3 – це слабка двохосновна кислота, існує лише в розбавлених розчинах1. Дисоціює двоступенево: Хімічні властивості Виявляє властивості кислот; при взаємодії з лугами може утворювати […]...
- КАРБОНАТНА КИСЛОТА ТА ЇЇ СОЛІ – ВУГЛЕЦЬ І ЙОГО СПОЛУКИ Хімія – універсальний довідник ВУГЛЕЦЬ І ЙОГО СПОЛУКИ КАРБОНАТНА КИСЛОТА ТА ЇЇ СОЛІ З хімічної точки зору оксид карбону (IV) – кислотний оксид із властивостями, характерними для даного класу неорганічних сполук. Йому відповідає карбонатна кислота Н2СО3. Це дуже нестійка сполука, у вільному вигляді не існує, та й у водних розчинах молекули карбонатної кислоти не виявляються. […]...
- Ступінь електролітичної дисоціації – Електролітична дисоціація ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 6. Суміші речовин. Розчини 6.6. Електролітична дисоціація 6.6.3. Ступінь електролітичної дисоціації Розчини можуть складатись із частинок розчинника, розчиненої речовини і продуктів їхньої взаємодії, а отже, у розчинах електролітів можуть дисоціювати не всі, а лише частина молекул. Кількісною характеристикою процесу дисоціації є ступінь дисоціації […]...
- Солі – ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК Солі Поняття про солі, їхній склад та назви Солі можна розглядати як продукти заміщення атомів Гідрогену в кислоті на атоми металічних елементів. Кухонну сіль, наприклад, можна добути з хлоридної кислоти за допомогою реакції заміщення. Солі – складні речовини, які […]...
- Солі натрію і калію – МЕТАЛИ ГОЛОВНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП § 13.4. Солі натрію і калію Натрій утворює солі з усіма кислотами. Майже всі його солі розчинні у воді. Найважливіші з них – хлорид натрію (кухонна сіль), сода і сульфат натрію. Хлорид натрію NaCl – необхідна приправа […]...
- Електролітична дисоціація. Електроліти й неелектроліти Тема 1 РОЗЧИНИ Урок 11 Тема уроку. Електролітична дисоціація. Електроліти й неелектроліти Цілі уроку: формувати уявлення учнів про процеси, що відбуваються в розчинах; ознайомити з поняттям “електролітична дисоціація”; пояснити залежність електролітичної дисоціації від будови молекул розчиненої речовини й розчинника; ознайомити учнів з поділом речовин на електроліти й неелектроліти за електропровідністю в розчині або розплаві. Тип […]...
- Електроліти та електролітична дисоціація – ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ Електроліти та електролітична дисоціація Усі речовини можна розділити на електроліти та неелектроліти. Електроліти – це речовини, розчини або розплави яких проводять електричний струм. Розчини й розплави неелектролітів електричний струм не проводять. До електролітів відносять речовини з іонною будовою, а також речовини […]...
- КИСЛОТИ І ОСНОВИ – ЕЛЕКТРОЛІТИ Хімія – універсальний довідник ЕЛЕКТРОЛІТИ КИСЛОТИ І ОСНОВИ Загальним для всіх кислот при їх взаємодії з водою є утворення іона оксонію Н3O+ (саме цей іон, зокрема, викликає зміну забарвлення індикаторів), тому більш точне визначення класу речовин-кислот порівняно з тим, яке було подано раніше, таке: Кислотою називається речовина, яка при взаємодії з водою (при розчиненні у […]...
- Ступінь дисоціації – РОЗЧИНИ ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина І. ЗАГАЛЬНА ХІМІЯ Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ § 5.9. Ступінь дисоціації Оскільки електролітична дисоціація – процес оборотний, то в розчинах електролітів поряд з їх іонами є й молекули. Тому розчини електролітів характеризуються ступенем дисоціації (позначається грецькою буквою “альфа” а). Ступінь дисоціації – це […]...
- Реакції обміну між розчинами електролітів, умови їх протікання Тема 1 РОЗЧИНИ УРОК 14 Тема уроку. Реакції обміну між розчинами електролітів, умови їх протікання Цілі уроку: показати процеси, що протікають у розчинах електролітів як реакції обміну між іонами; ознайомити з умовами їх протікання; формувати навички складання іонних рівнянь. Тип уроку: формування вмінь і навичок та їх творчого застосування. Форми роботи: розповідь учителя, демонстраційний експеримент, […]...
- Хімічні властивості основ – ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК Хімічні властивості основ Луги Нерозчинні гідроксиди Змінюють забарвлення індикаторів Взаємодіють із кислотами з утворенням солі й води (реакція нейтралізації): 2KOH + H2SO4 → K2SO4 + 2Н2O Взаємодіють із кислотами з утворенням солі й води (реакція нейтралізації): Fe(OH)2 + H2SO4 […]...
- ГІДРОЛІЗ СОЛЕЙ – ВУГЛЕЦЬ І ЙОГО СПОЛУКИ Хімія – універсальний довідник ВУГЛЕЦЬ І ЙОГО СПОЛУКИ ГІДРОЛІЗ СОЛЕЙ У нейтральних розчинах, тобто за відсутності кислот і лугів, у результаті дисоціації (дуже слабкої) води утворюються однакові кількості іонів Н+ і ОН-: Додавання до води кислоти збільшує концентрацію іонів Н+ і, зміщуючи рівновагу дисоціації води вліво, знижує концентрацію іонів ОН-. Отже, кислий розчин містить більше […]...