Сполуки Сульфуру(ІV)
РОЗДІЛ 2 НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ
ХІМІЧНІ ЕЛЕМЕНТИ ГРУПИ (ХАЛЬКОГЕНИ)
§ 28. Сполуки Сульфуру(ІV)
Усвідомлення змісту цього параграфа дає змогу:
Характеризувати склад сульфур(ІV) оксиду, сульфітної кислоти та її солей, фізичні та хімічні властивості, добування і практичне значення;
Визначати сульфіт-іони в розчинах;
Складати рівняння реакцій та схеми електронного балансу відповідних хімічних реакцій.
Найбільше значення серед сполук Сульфуру зі ступенем окиснення +4 має сульфур(IV) оксид, або сірчистий газ SO2,
У цих сполуках Сульфур утворює чотири ковалентні полярні зв’язки з атомами Оксигену (мал. 41).
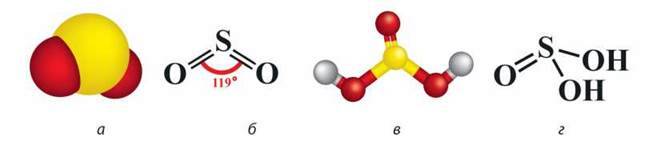
Мал. 41. Молекула SO2: а – модель, б – просторова будова; молекула H2SO3: в – модель, г – просторова будова
– Поясніть здатність атома Сульфуру утворювати чотири ковалентні зв’язки і набувати позитивного ступеня окиснення +4.
Поширеність у природі. Значна кількість сірчистого газу викидається в атмосферу під час виверження вулканів. У деяких місцях сірчистий газ виділяється з тріщин земної кори. Нещодавно вчені
Фізичні властивості. Сульфур(ІV) оксид має молекулярну кристалічну гратку. Це газ без кольору, з різким запахом, важчий за повітря. За температури -10 °С він зріджується й утворює безбарвну рідину, яка розчиняє гуму і деякі пластмаси. Добре розчиняється у воді (за н. у. в одному об’ємі води розчиняється 40 об’ємів SO2).
Фізіологічна дія. Сульфур(ІV) оксид дуже токсична речовина. При вмісті в атмосфері лише 0,3 % він спричиняє бронхіт чи пневмонію, а при збільшенні вмісту – навіть смерть.
Сірчистий газ є одним з основних забруднювачів атмосфери антропогенного походження. Саме цей оксид вважається найбільш шкідливим для людини, бо погіршує загальний стан здоров’я і позначається на тривалості життя.
Добування. У промисловості сульфур (IV) оксид одержують спалюванням сірки, випалюванням сульфідних руд, наприклад піриту:
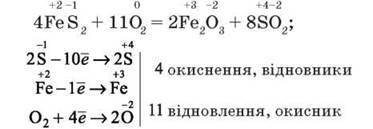
У лабораторії сульфур (IV) оксид добувають взаємодією сульфатної кислоти з масовою часткою H2SO4 70 % із кристалічними сульфітами. Колбу Вюрца наповнюють великими грудками натрій сульфіту, з крапельної лійки добавляють сульфатну кислоту. Газ, що утворюється внаслідок розкладу нестійкої H SO, збирають у посудину витісненням повітря:
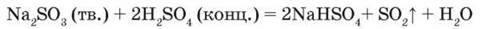
Хімічні властивості. Сульфур(IV) оксид – кислотний оксид, ангідрид сульфітної кислоти – розчиняється у воді з утворенням розчину сульфітної кислоти:
SO2 + H2O – H2SO3
Рівновага зміщена вліво, утворюються гідрати змінного складу SO2 – nH2O. Сульфітна кислота – нестійка сполука, легко розкладається на сірчистий газ і воду, тому існує тільки у водних розчинах. Належить до електролітів середньої сили. Як двохосновна кислота дисоціює ступінчасто з утворенням гідрогенсульфіт-іонів HSO – та сульфіт-іонів SO|-:
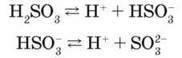
У водних розчинах сульфітної кислоти існує рівновага:
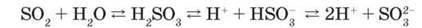
Відповідно до ступінчастої дисоціації утворює кислі солі – гідрогенсульфіти NaHSO3 і середні – сульфіти Na2SO3.
Сульфур(IV) оксид і сульфітна кислота взаємодіють: з основними та амфотерними оксидами із утворенням солей:
SO2 + СаО = СаSO3; SO2 + ZnO = ZnSO3
H2SO3 + CaO = CaSO3 + H2O; H2SO3 + ZnO = ZnSO3+ H2O
З основами із утворенням солей:
SO2 + 2NaOH = Na2SO3+ H2O
H2SO3 + 2NaOH = Na2SO3+ 2H2O
Сульфітна кислота взаємодіє з розчинами солей:
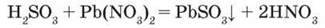
– Для реакцій за участю електролітів напишіть рівняння в йонних формах.
Якісна реакція на сульфітну кислоту та її солі. Реактивом на сульфіт-іон 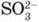 Є катіон Гідрогену Н+, тобто будь-яка сильна кислота.
Є катіон Гідрогену Н+, тобто будь-яка сильна кислота.
Сульфітна кислота, що утворюється в ході реакції, розкладається з виділенням сірчистого газу, який визначають за характерним запахом і зміною кольору зволоженого лакмусового паперу:
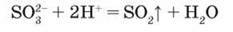
– Напишіть хімічне і повне йонне рівняння реакцій.
Окисно-відновні властивості сполук Сульфуру(IV). Проміжний ступінь окиснення Сульфуру +4 у сульфур (IV) оксиді, сульфітній кислоті та сульфітах зумовлює їх участь в окисно-відновних процесах як окисника або відновника.
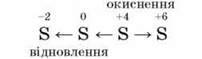
Так, відновні властивості сполуки Сульфуру (IV) виявляють в реакціях з сильнішими окисниками: киснем, галогенами, калій пермангaнaтом:
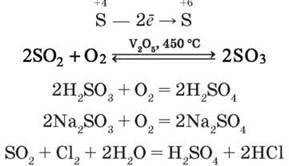
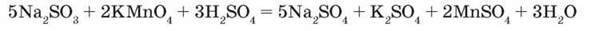
– Складіть схеми електронного балансу цих реакцій.
Окиснювальні властивості сполук Сульфур (IV) виявляються в реакціях з сильними відновниками: 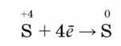
Ілюстрацією окиснювальних властивостей сульфур(ІV) оксиду є його реакція з сірководнем, яка відбувається у вулканічних газах (мал. 42):
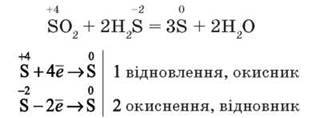

Мал. 42. Сірка на схилі вулкана
Утворення сірки досить легко спрогнозувати, бо окисником і відновником є один елемент – Сульфур, який у продукті реакції матиме проміжний ступінь окиснення відносно ступеня окиснення в реагентах.
У даному випадку це єдиний можливий варіант ступеня окиснення
Сульфуру – 
Аналогічно взаємодіє з сірководнем і сульфітна кислота:
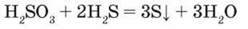
– Складіть схеми електронного балансу.
Реакцію взаємодії сірчистого газу з сірководнем застосовують для добування сірки із сірководню, виділеного з супутніх нафтових газів. Сірчистий газ для реакції добувають спалюванням частини сірководню.
Застосування сполук Сульфуру(ІV). Окиснення сульфур (IV) оксиду до сульфур(IV) оксиду є проміжним, але обов’язковим етапом добування сульфатної кислоти.
Сірчистий газ SO2 і солі сульфітної кислоти натрій гідрогенсульфіт NaHSO3 та натрій сульфіт Na2SO3 застосовують як м’які окисники для вибілювання паперу, соломи, вовни та шовку, кукурудзяного борошна. Іноді ця реакція може бути оборотною, і колір, наприклад соломи, через деякий час відновлюється.
Сірчистий газ знищує багато мікроорганізмів. Тому його використовують як дезинфікуючий засіб в овочесховищах, для знищення плісняви в бродильних чанах, захисту плодових рослин від хвороб і шкідників. Окрім того, його застосовують як консервант для зберігання овочів та фруктів.
Коротко про головне
Сполуками Сульфуру(IV) є сульфур(IV) оксид SО2 – сірчистий газ, сульфітна кислота H2SO3 та її солі: середні – сульфіти Na2SO3, кислі – гідрогенсульфіти NaHSO3. Сульфур(IV) оксид – речовина молекулярної будови, що зумовлює її фізичні властивості; дуже отруйна.
Сульфітна кислота – нестійка сполука, тому існує тільки в розчині. Електроліт середньої сили. Як двохосновна кислота дисоціює ступінчасто з утворенням гідрогенсульфіт-іонів HSO-3 та сульфіт-іонів SO3-.
Сульфур (IV) оксид і сульфітна кислота виявляють типові кислотні властивості. Як сполуки, що містять Сульфур з проміжним ступенем окиснення, залежно від властивостей іншого реагенту виявляють відновні (при взаємодії з сильнішими окисниками) або окиснювальні (при взаємодії з сильнішими відновниками) властивості. Реактивом на сульфіт-іон SO23- є катіон Гідрогену (Н+) у складі будь-якої сильної кислоти. Ознака реакції – виділення сірчистого газу, який розпізнають за характерним запахом і почервонінням вологого лакмусового паперу. Застосування сполук Сульфуру(ІV) зумовлене їх окиснюваль – ними (вибілювальна і дезинфікуюча дії) і відновними (добування сульфур(VІ) оксиду) властивостями.