Сполуки Сульфуру(VІ)
РОЗДІЛ 2 НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХ СПОЛУКИ
ХІМІЧНІ ЕЛЕМЕНТИ ГРУПИ (ХАЛЬКОГЕНИ)
§ 29. Сполуки Сульфуру(VІ)
Усвідомлення змісту цього параграфа дає змогу:
Характеризувати склад, фізичні та хімічні властивості, добування і практичне значення сульфур(VІ) оксиду, сульфатної кислоти, її солей; визначати сульфат-іони у розчинах;
Складати рівняння та схеми електронного балансу відповідних хімічних реакцій;
Дотримуватися правил безпечного поводження з розчином сульфатної кислоти.
До сполук Сульфуру(VІ) належать Сульфур(VІ)
Сульфур(VІ) оксид – вищий оксид Сульфуру. За стандартних умов – це безбарвна летка рідина з різким запахом, що складається переважно з циклічних тримерів (SO3)3 (мал. 43, в). Окремі молекули в газуватому стані мають форму плоского правильного трикутника, у центрі якого максимально окиснений атом Сульфуру, а у вершинах – атоми Оксигену. Всі атоми розміщені в одній площині, валентні кути 120° (мал. 43, а, б).
Сульфур(VІ) оксид здатний розчинятись у концентрованій сульфатній кислоті. Цей розчин називається олеумом, максимально він може містити 65 % SO3. Добувають вищий
Фізіологічна дія. SO3 – токсична речовина, яка уражає слизові оболонки і дихальні шляхи, руйнує органічні сполуки. Зберігається в запаяних скляних посудинах.
Хімічні властивості. Сульфур(VІ) оксид є типовим кислотним оксидом. Енергійно реагує з водою з утворенням сульфатної кислоти.
Це екзотермічний процес, що супроводжується виділенням значної кількості теплоти:
SO3 + H2O = H2SO4, ∆Н = -90 кДж/моль
– Напишіть рівняння реакцій, що характеризують сульфур(VІ) оксид як кислотний.
Сульфур(VІ) оксид – сильний окисник, що зумовлено максимальним ступенем окиснення Сульфуру +6. Як правило, відновлюється до сірчистого газу:
SO3 + 2HCl = Cl2 + SO2 + H2O
– Складіть схеми електронного балансу.
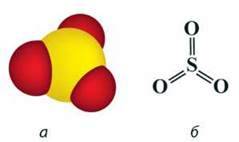
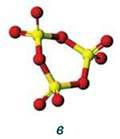
Мал. 43. Молекула SO3: а – модель; б – просторова будова; в – модель тримера (SO3)3
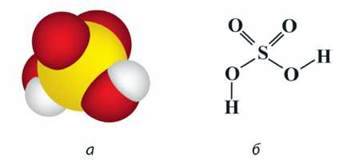
Мал. 44. Молекула H2SO4: а – модель; б – просторова будова
Сульфатна кислота H2SO4 – речовина молекулярної будови (мал. 44).
– Поясніть здатність атома Сульфуру утворювати шість ковалентних зв’язки і набувати позитивного ступеня окиснення +6.
Фізичні властивості. Безводна сульфатна кислота – це важка безбарвна оліїста рідина, нелетка, без запаху, не проводить електричний струм.
У лабораторії використовують розчин з масовою часткою H2SO4 96 %. Таку кислоту називають концентрованою (р = 1,84 г/см3).
Сульфатна кислота надзвичайно гігроскопічна речовина – змішується з водою у будь-яких пропорціях. Розчинення у воді супроводжується суттєвим зменшенням об’єму і виділенням великої кількості теплоти.
Доведено, що розчинення сульфатної кислоти у воді – фізико – хімічний екзотермічний процес утворення гідратів:
H2SO4 + raH2O = H2SO4 – nH2O
При розбавленні сульфатної кислоти треба дотримуватися певних правил.
Не можна воду доливати до концентрованої сульфатної кислоти!
Кислоту треба доливати у воду невеликими порціями при постійному перемішуванні, інакше відбудеться сильне розбризкування розігрітого і небезпечного розчину сульфатної кислоти. У разі потрапляння на шкіру спричиняє тяжкі опіки.
Хімічні властивості. Сульфатна кислота є дуже реакційноздатною речовиною. Хімічні властивості значною мірою залежать від її концентрації, хоча поділ на концентровану і розбавлену кислоти достатньо умовний.
Розбавлена сульфатна кислота – сильний електроліт, виявляє типові хімічні властивості кислот. Як двохосновна кислота дисоціює ступінчасто з утворенням гідрогенсульфат-іонів HSO4 і сульфат-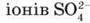
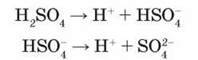
Утворює два види солей: кислі – гідрогенсульфати, наприклад, NaHSO4, і середні – сульфати, наприклад Na2SO4.
За таблицею розчинності визначимо розчинність сульфатів. Пересвідчимося, що більшість сульфатів добре розчиняється у воді. Малорозчинними є кальцій сульфат CaSO4 та аргентум(І) сульфат Ag2SO4, ще менш розчинним – плюмбум(ІІ) сульфат PbSO4, практично нерозчинним – барій сульфат BaSO4.
-Як сильна і нелетка сульфатна кислота реагує з солями, утвореними слабшими і леткими кислотами:
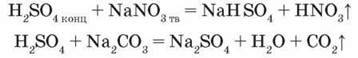
Цю властивість сульфатної кислоти використовують для добування в лабораторії летких кислот: хлоридної, сульфідної, сульфітної, нітратної.
– Напишіть рівняння наведених реакцій у йонних формах. Поясніть, чому розбавлена сульфатна кислота виявляє типові хімічні властивості класу кислот.
Коротко про головне
Основні сполуки Сульфуру(VІ) – сульфур(VІ) оксид S03, сульфатна кислота H2SO4, солі сульфатної кислоти: кислі – гідрогенсульфати, середні – сульфати. Сульфур(VІ) оксид S03 – речовина молекулярної будови, типовий кислотний оксид, токсичний. Сульфатна кислота H2SO4 – найважливіша з мінеральних кислот, сильний електроліт. Типові кислотні властивості розбавленої сульфатної кислоти зумовлені наявністю в її розчині катіонів Гідрогену Н+. Окиснювальні властивості сульфур(УІ) оксиду і концентрованої сульфатної кислоти пов’язані з максимальним ступенем окиснення Сульфуру +6. Повнота відновлення S+6 залежить від активності відновника. Сульфати багатьох металічних елементів кристалізуються із розчинів з утворенням кристалогідратів різного складу. Кристалогідрати сульфатів важких металічних елементів називаються купоросами. Реактивом на сульфат-іон є катіон Ва2+ – ВаСl2 або Ba(NO3) 2, а ознакою – білий кристалічний осад, нерозчинний у нітратній кислоті.
Сульфатна кислота надзвичайно гігроскопічна, спричиняє сильні хімічні та термічні опіки. Сполуки Сульфуру(VІ) широко використовуються в різних галузях господарства. Сульфатну кислоту називають “хлібом хімічної промисловості”, це стратегічний вид продукції.
Для допитливих. Існує думка, що сульфатну кислоту добувають тільки штучно. Однак вона є в природних водах вулканічного походження. Так, вода південноамериканської річки Ель Ріо Винагре (“Кисла”), що бере початок поблизу діючого вулкана Пурасе у Кордильєрах, містить 0,1 % сульфатної кислоти. Щороку річка виносить в океан до 20 т H2SO4. А в тілі деяких равликів уміст сульфатної кислоти становить 4 %.