Сучасне формулювання періодичного закону Ізотопи
Тема 3
ПЕРІОДИЧНИЙ ЗАКОН І ПЕРІОДИЧНА СИСТЕМА ХІМІЧНИХ ЕЛЕМЕНТІВ Д. І. МЕНДЕЛЄЄВА. БУДОВА АТОМА
УРОК 45
Тема. Сучасне формулювання періодичного закону Ізотопи
Цілі уроку: розширити знання про періодичний закон і періодичну систему хімічних елементів Д. І. Менделєєва; формувати поняття про ізотопи (стабільні й нестабільні); дати уточнене визначення поняттю “хімічний елемент” виходячи зі знань періодичного закону – фундаментального закону природи; дати сучасне формулювання періодичного закону
Тип уроку: засвоєння
Форми роботи: розповідь учителя, фронтальна робота з навчальною літературою.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, таблиця розчинності.
ХІД УРОКУ
I. Організація класу
II. Перевірка домашнього завдання, мотивація навчальної діяльності
Завдання класу (фронтальна бесіда)
– Чому явище радіоактивності було сприйняте як катастрофа періодичного закону й періодичної системи?
У результаті розпаду атомів радіоактивних елементів утворювалися атоми вже відомих елементів, але з іншими атомними масами. А періодична система була побудована
III. Засвоєння знань, умінь і навичок
У результаті експериментальних досліджень було встановлено, що, наприклад, у природному кисні, крім атомів Оксигену з масою 16, є також атоми Оксигену з масою 17 і 18. їх співвідношення таке:
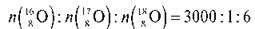
Виявилося, що інші елементи також складаються з атомів з різною масою. Так, у природній воді, крім атомів Гідрогену з масою 1, є також атоми Гідрогену з масою 2; співвідношення чисел цих атомів таке:
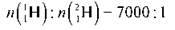
В ядерних реакціях також одержано Гідроген з атомною масою 3: 31H. Причому “важка вода” шкідлива для живих організмів. Тож притчі про “живу” і “мертву” воду мають реальне наукове пояснення.
Учні розглядають таблицю “Ізотопи деяких елементів, виявлених у земній корі”.
Назва елемента | Число ізотопів | Масові числа |
Гідроген | 3 | 1,2, 3 |
Оксиген | 3 | 16, 17, 18 |
Хлор | 2 | 35, 36 |
Кальцій | 6 | 40,42,43,44,46,48 |
Ферум | 4 | 54, 56, 57, 58 |
Уран | 3 | 234, 235, 238 |
Різновиди атомів того самого хімічного елемента, що мають однакове число протонів у ядрі, але різну масу, називають ізотопами. “Ізотоп” означає “той, що займає те саме місце”.
Розглянемо характеристики ізотопів Гідрогену й Оксигену.
8160 | 8170 | 8180 | P1 = p2 = p3 N = 8, 9, 10 |
P = 8 | P = 8 | P = 8 | |
E = 8 | E = 8 | E = 8 | |
N = 8 | N = 9 | N = 10 | |
11H (Протій) | 12H (Дейтерій) | 13H (Тритій) | |
P = 1 | P = 1 | P = 1 | |
E = 1 | E = 1 | E = 1 | |
N = 1 – 1 = 0 | N = 2 – 1 = 1 | N = 3 – 1 = 2 |
У природі існують хімічні елементи ізобари – атоми, що мають однакове атомне число, але різні величини зарядів ядра, наприклад:
4018Аr і 4019К.
Атомні маси елементів у періодичній системі є середнім значенням масових чисел природних сумішей ізотопів. Тому вони не можуть, як пропонував Д. І. Менделєєв, служити головною характеристикою атома, а отже, й елемента. Такою характеристикою, як ми тепер знаємо, є заряд ядра. Він визначає число електронів у нейтральному атомі, які розподіляються цілком визначено навколо ядра. Характер же розподілу електронів визначає хімічні властивості атомів. Зазначені міркування дозволили дати нове визначення хімічного елемента:
Хімічний елемент – це сукупність атомів з однаковим зарядом ядра. А також уточнити формулювання періодичного закону:
Властивості елементів, а також властивості й форми їхніх сполук перебувають у періодичній залежності від заряду ядра атома елемента.
Чому ж атомні маси більшості елементів дробові? З’ясувалося, що слід розмежовувати поняття “відносна атомна маса” і “відносна атомна маса елемента”. Значення відносних атомних мас ізотопів дуже близькі до цілих чисел. Відносні ж атомні маси елемента як сукупності ізотопів виражаються дробовими числами. Наприклад, відносна атомна маса елемента Хлору – 35,5. Відмінність цих понять неважко зрозуміти. Відносна атомна маса елемента розраховується з урахуванням масової частки ізотопів у природі.
Елемент Хлор складається з двох ізотопів з відносними атомними масами, дуже близькими до 35 і 37. Ізотопу 1735Сl в природній суміші міститься 15%, а ізотопу 1737Сl – 25 %. Звідси середня відносна атомна маса елемента Хлору дорівнює
Ar = 35 – 0,75 + 37 – 0,25 = 35,5
Отже, атомна маса елемента тим більша, чим більше важких ізотопів входить до складу елемента.
Можна пояснити аномалію в положенні в періодичній системі Калію й Аргону, розрахувавши їх відносну атомну масу з урахуванням природних ізотопів:
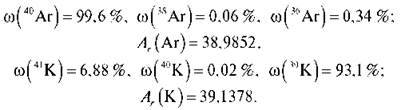
Ізотопи поділяються на стабільні й радіоактивні. Натрій, Алюміній, Флуор не мають стабільних ізотопів. У Стануму їх десять.
Якщо всі ізотопи елемента є радіоактивними, то його відносна атомна маса в періодичній системі зазначена у квадратних дужках. Розрізняють природні радіоактивні ізотопи (Уран) та ізотопи штучного походження – радіонукліди, що утворюються в результаті випробувань атомної зброї, під час роботи ядерних виробництв.
Небезпечні ізотопи: 3890Sr (заміщає в кістках Са), 35137Cs, 53113І. Радіоактивні ізотопи в процесі радіоактивного випромінювання розпадаються на атоми інших елементів, унаслідок чого відбувається ядерна реакція, що супроводжується шкідливим випромінюванням:
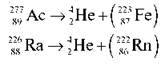
Швидкість радіоактивного випромінювання характеризується періодом напіврозпаду й може тривати від частки секунди до мільярдів років. Більш докладно явище радіоактивності ви вивчатимете в курсі фізики. У хімічних реакціях радіоактивні перетворення атомів не відбуваються.
IV. Закріплення знань, умінь і навичок
Практика на прикладах
(Учні отримують аркуш із завданнями.)
Завдання 1. Знайдіть серед елементів такий, відносна атомна маса якого – 23, а число протонів – 18:

Завдання 2. Знайдіть серед елементів такий, відносна атомна маса якого – 40, а число протонів -11.

Завдання 3. Обчисліть відносну атомну масу атомів Аргону й Гелію за такими даними:
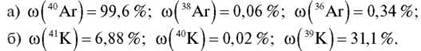
Одержаний результат пояснює аномалію розташування цих хімічних елементів у періодичній системі хімічних елементів Д. І. Менделєєва.
V. Підбиття підсумків уроку
1. Чим формулювання періодичного закону, запропоноване Д. І. Менделєєвим, відрізняється від сучасного формулювання цього закону?
2. Як можна перетворити свинець на золото?
3. Що таке ізотопи? Як вони розміщаються в періодичній системі хімічних елементів?
4. Чому елементи з великою атомною масою в природі зустрічаються нечасто?
5. Що ще ви хотіли б дізнатися в цій темі?
VI. Домашнє завдання
Опрацювати відповідний параграф підручника і відповісти на запитання.
Повторити будову атомів хімічних елементів I-III періодів.