Теорія електролітичної дисоціації. Іонні реакції
I СЕМЕСТР
ПОВТОРЕННЯ ОСНОВНИХ ПИТАНЬ КУРСУ ХІМІЇ ОСНОВНОЇ ШКОЛИ (4 год.)
УРОК 3
Тема уроку. Теорія електролітичної дисоціації. Іонні реакції
Цілі уроку: актуалізувати знання учнів про процеси, що протікають у розчинах; узагальнити знання про електролітичну дисоціацію речовин; удосконалювати вміння й навички складання повних і скорочених іонно-молекулярних рівнянь реакцій.
Тип уроку: повторення й систематизації знань.
Форми роботи: фронтальна, групова, самостійна.
Обладнання: періодична система хімічних елементів,
Лабораторний дослід 1. Визначення іонів H+ і OH-.
ХІД УРОКУ
I. Організація класу
II. Актуалізація опорних знань учнів з теми
“Теорія електролітичної дисоціації. Іонні реакції”
Фронтальна бесіда за основними питаннями теми
(з використанням схеми 3)
1. Теорія електролітичної дисоціації
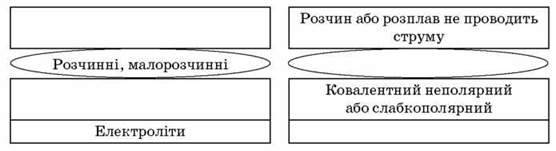
Які речовини належать до електролітів? неелектролітів?
Речовини з іонним або дуже полярним ковалентним зв’язком можуть у процесі розчинення або плавлення (іонні речовини) утворювати рухливі іони, за рахунок яких ці розчини або розплави
Які іони міститимуться у водних розчинах нижченаведених речовин?
1) Na2CO3;
2) NaHSO3;
3) Fe2(SO4)3;
4) Ca(OH).
Електролітами є:
– солі:
NaCl = Na+ + Cl-
– основи:
NaOH = Na+ + OH-
– кислоти:
HCl = H+ + Cl-
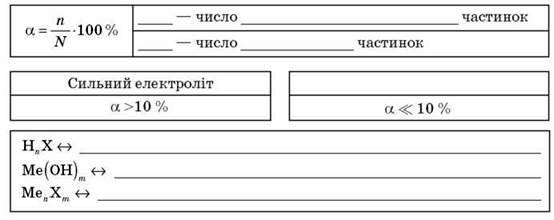
Що показує ступінь дисоціації?
Ступінь дисоціації? – це відношення числа молекул, що продисоціювали в розчині, до вихідного числа молекул розчиненої речовини. Ступінь дисоціації залежить від концентрації й температури. Зі збільшенням концентрації ступінь дисоціації зменшується, а з підвищенням температури – зростає.
Сильні електроліти – це електроліти, які в розведеному розчині повністю дисоціюють на іони (? > 1).
Слабкі електроліти – це електроліти, які в розведеному розчині дисоціюють частково й незначною мірою (? > 0).
Деякі електроліти (кислоти або основи) дисоціюють поетапно:
H2S 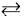 H+ + HS – – перший етап;
H+ + HS – – перший етап;
HS – 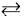 H+ + S2- – другий етап.
H+ + S2- – другий етап.
Ступінь дисоціації на другому етапі завжди менший, ніж на першому.
Властивості розведених розчинів сильних електролітів визначаються властивостями іонів, що містяться в цих розчинах (молекули в них відсутні): властивості кислот – властивостями іонів Гідрогену, властивості лугів – властивостями гідроксид-іонів, властивості солей – властивостями іонів, що входять до їх складу.
2. Лабораторний дослід 1. Визначення H+ і OH-. В який спосіб можна визначити наявність іонів H+ і OH – ?
Дослідіть розчини хлоридної кислоти, натрій гідроксиду, натрій хлориду, натрій карбонату, ферум(ІІ) хлориду універсальним індикатором. Зробіть висновок про середовище в цих розчинах.
3. Гідроліз солей
Під час розчинення багатьох солей у воді протікають реакції обміну між іонами солі й молекулами води, у результаті яких можуть утворюватися слабкі електроліти, газоподібні речовини або малорозчинні речовини. Унаслідок цього рівновага дисоціації води (H2O 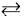 H + OH-) зсувається праворуч. Залежно від того, які іони (H+ чи OH-) зв’язуються в продуктах гідролізу, водний розчин солі може мати кисле (рН < 7), лужне (рН > 7) або нейтральне (рН = 7) середовище.
H + OH-) зсувається праворуч. Залежно від того, які іони (H+ чи OH-) зв’язуються в продуктах гідролізу, водний розчин солі може мати кисле (рН < 7), лужне (рН > 7) або нейтральне (рН = 7) середовище.
Процес іонного обміну солі й води називається гідролізом.
Гідролізуються солі слабких кислот або слабких основ. Солі, утворені сильною кислотою й сильною основою, не гідролізуються. Поясніть, чому.
Можливі випадки гідролізу
– Сіль, утворена слабкою кислотою й сильною основою (Na2CO3, K2S, CH3COONa):
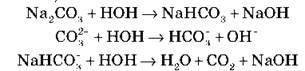
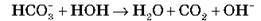 (середовище лужне)
(середовище лужне)
– Солі, утворені сильною кислотою та слабкою основою (NH4Cl, ZnCl2, Al(NO3)3):
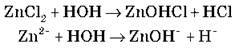
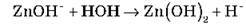 (середовище кисле)
(середовище кисле)
– Солі, утворені слабкою основою та слабкою кислотою (MgS, Zn(CH3COO)2, NH4CN):
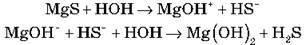
(середовище залежатиме від константи дисоціації кислоти й основи)
III. Керована практика
Групова робота
Завдання 1. Складіть рівняння дисоціації речовин.
“Естафета” по групах (завдання на картках)
Приклади речовин:
А) 2Mg3(PO4)2, 3FeCl2, 2H3PO4, 2Na2S, CuCl2, 4Cl2O5;
Б) 2Cu(OH), 3H2S, AgNO3, 4NaOH, CuO, 5Cl2;
В) 2Al(NO3)3, AgCl, 3Li3P04, 3H2SO3, 4KOH, CaO;
Г) 3FeCl3, 2Na3PO4, 3H2S, 2K2S04, 3Cu(OH), 5CO2.
Складіть рівняння реакцій іонного обміну, запишіть їх у іонно-молекулярній формі:
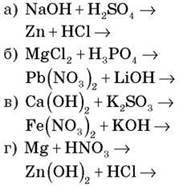
Під час проведення “естафети” кожен учень записує лише один вид рівняння (перший учень дописує молекулярне, зрівнює, другий складає рівняння в повній іонній формі, а третій – у скороченій іонній).
Завдання 2. У розчині виявлено іони: Na+, Cu2+, SO42-, Fe3+, K+, Cl-, H+. Які речовини могли міститися в розчині? Підтвердьте відповідь, написавши відповідні формули речовин і рівняння їх дисоціації.
Завдання 3. Чи можна приготувати розчини, які одночасно містять такі пари речовин:
А) магній хлорид і калій сульфат;
Б) калій нітрат і натрій хлорид;
В) аргентум нітрат і калій хлорид?
Відповідь підтвердьте рівняннями реакцій у молекулярній, повній та скороченій іонних формах.
Завдання 4. Наведіть кілька варіантів одержання алюміній гідроксиду. Підтвердьте їх рівняннями реакцій у молекулярній, повній та скороченій іонних формах.
Завдання 5. Підберіть до іонного рівняння три молекулярні рівняння:
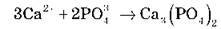
Завдання 6. Обчисліть масову частку сульфатної кислоти в розчині, що утворився в результаті змішування 500 г розчину з масовою часткою сульфатної кислоти 60 % і 300 г розчину з масовою часткою кислоти 40 %.
Завдання 7. У якій масі води слід розчинити 100 г кристалогідрату MgSO4 – 7H2O для приготування розчину з масовою часткою магній сульфату 5 %?
Завдання 8. Який об’єм газу (н. у.) виділиться в результаті злиття 150 г розчину хлоридної кислоти з масовою часткою кислоти 30 % і розчину натрій карбонату?
IV. Підбиття підсумків і висновки
Самостійна робота за варіантами
Варіант І
1. Напишіть молекулярне, повне та скорочене іонні рівняння реакцій між розчинами:
А) плюмбум(ІІ) нітрату й натрій хлориду;
Б) калій гідроксиду й сульфатної кислоти;
В) купрум(ІІ) сульфату й натрій гідроксиду.
(4 бали)
2. Підберіть три молекулярні рівняння до іонного рівняння:
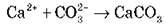
(4 бали)
3. Із 700 г розчину з масовою часткою сульфатної кислоти 60 % шляхом випарювання видалили 200 г води. Обчисліть масову частку сульфатної кислоти в розчині, що залишився.
(4 бали)
Варіант ІІ
1. Напишіть молекулярне, повне та скорочене іонні рівняння реакцій між розчинами:
А) калій карбонату та хлоридної кислоти;
Б) кальцій гідроксиду й сульфатної кислоти;
В) натрій хлориду й фосфатної кислоти.
(4 бали)
2. Підберіть три молекулярні рівняння до іонного рівняння:
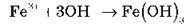
(4 бали)
3. З 1000 г розчину з масовою часткою калій нітрату 20 % унаслідок охолодження випало в осад 40 г солі. Обчисліть масову частку калій нітрату в розчині, що залишився.
(4 бали)
V. Домашнє завдання
Повторити окисно-відновні реакції.
Які із запропонованих іонів не можуть одночасно міститися в розчині?
H+, K+, Cu2+, Al3+, OH-, S2-, NO-.
Розставте коефіцієнти методом електронного балансу:
HgS + CaO  Hg + CaSO4
Hg + CaSO4
Обчисліть масу солі й води, необхідні для приготування 400 г розчину з масовою часткою речовини 17 %.
Додаток
Схема 3
Електролітична дисоціація
Гідратація – _____________________________________________
Дисоціація – _____________________________________________
Електролітична дисоціація – _______________________________
Гідроліз – _______________________________________________
Рівняння дисоціації

Ступінь дисоціації
Алгоритм складання рівнянь реакцій іонного обміну
1. Скласти рівняння, у якому формули всіх речовин записані в молекулярній формі, і зрівняти це молекулярне рівняння.
2. Визначити електроліти й неелектроліти.
3. Формули електролітів написати у вигляді іонів, а формули неелектролітів переписати в молекулярній формі – повне іонне рівняння.
4. Переписати рівняння без тих іонів, які є й у лівій, і в правій частинах рівняння, – скорочене іонне рівняння.