Вправа 131-138
№ 131.
А) Кисень – проста речовина Оксигена;
Б) вода утворена Гідрогеном і Оксигеном;
В) молекула кисню складається із двох атомів Оксигену;
Г) у результаті фотосинтезу рослини поглинають вуглекислий газ, а виділяють кисень.
№ 132.
У повітрі найбільше газів:
– азот N2 – 78,08 %;
– кисень O2 – 20,95 %.
№ 133.
Атоми Оксигену містяться у простих природних речовинах: кисень O2 (атмосфера), у складних:
– вода Н2O (гідросфера);
– пісок SiO2 (літосфера);
– органічні речовини – білки, жири, вуглеводи.
№
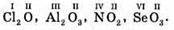
№ 135.
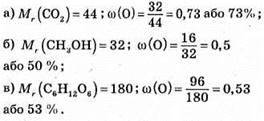
№ 136.
Дано:
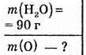
Розв’язання
Мr(Н2O) = 18 МІСТИТЬ 16 Г Оксигену;
M(Н2O) = 90 г – x г Оксигену 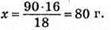
Відповідь: m(О) = 80 г.
№ 137.
Дано:
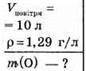
Розв’язання
1. Обчислимо масу повітря: m = ρ • V, m = 1,29 • 10 = 12,9 г.
2. За таблицею 2 масова частка кисню в повітрі складає 23,14 %, або 0,2314.
3. Обчислимо масу Кисню з формули:
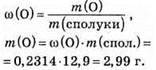
Відповідь: m(O) = 2,99 г.
№ 138.
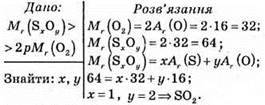
Відповідь: формула сполуки SO2.
Related posts:
- Вправа 195-204 № 195. Відповідь: m(р. р.) = 6 г. № 196. Дано: Розв’язання 1. Обчислимо m розчину: 2. Обчислимо масову частку розчиненої речовини: Відповідь: ω(цукру) = 0,2 або 20 %. № 197. M (р-ну), г M (р. р.), г M (води), г ω(р. р.) 400 8 392 0,02 або 2 % 500 40 460 0,08 або […]...
- Вправа 205-210 № 205. Гідроксиди – сполуки металічних елементів із загальною формулою М(ОН)n (М – металічний елемент). Основи – це гідроксиди Натрію, Калію, Барію, кальцію, інших металічних елементів. Луги – це розчинні у воді основи. № 206. № 207. № 208. Відповідь: a) 56,3 %; б) 65,3 %. № 209. Дано: Розв’язання 1. Обчислимо масу NaOH: (бо […]...
- Вправа 146-152 № 146. Добування кисню у промисловості: 1. З повітря: – охолодження повітря і перетворення його на рідину; – підвищення температури та виділення газу азоту, потім кисню. № 147. Реакції розкладу – це реакції, під час яких із однієї речовини утворюється кілька інших. № 148. № 149. Каталізатор – речовина, яка спричиняє перебіг реакції або прискорює […]...
- Вправа 26 Вправа 26 1. Дано: С; λ1 Розв’язання: За формулою λ – v? Т, маємо λ1 – сТ, λ2 = vТ. Із маємо λ1 = 9λ2; λ1= 9 · vΤ. Отже, сТ = 9 · vΤ, звідси Відповідь: швидкість поширення зменшиться у 9 разів. 2. Дано λ = 500 м T = T V = 3000Гц […]...
- Вправа 31 Вправа 31 1. Дано: λ1= 400 нм = = 4 · 10-7 м λ2 =760 нм = = 760 · 10-9 м С = З 108 м/с А = 6,626 · 10-34 Джс Розв’язання: Обчислимо значення: Відповідь: 5 ? 10-19 Дж; 2,6 · 10-19 Дж; 1,66 ? 10-27 кг(м/с); 8,7 ? 10-28 кг(м/с); 5,5 ? […]...
- Вправа 115-124 № 115. Масова частка елемента у сполуці обчислюється, якщо відомі маса елемента і відповідна маса сполуки (а). Масова частка елемента – це відношення маси елемента до відповідної маси сполуки. Її виражають або у% , або частках від 1. № 116. Масова частка елемента у простій речовині дорівнює 1. Тому що проста речовина утворена одним хімічним […]...
- Вправа 24 Вправа 24 1. Дано: V = 20 м/с Т = 0,5 с Розв’язання: Довжину хвилі можна визначити за формулою λ = v? T Обчислимо значення: λ = 20 м/с? 0,5 с = 10 м. Відповідь: довжина хвилі 10 м. λ – ? 2. Дано: λ = 300 м Т = 15 с V – ? […]...
- Вправа 25 Вправа 25 1. Дано: С = 2 пФ = = 2 ? 10-12Ф L = 0,5 мкГн = = 0,5 ? 10-6 Гн Розв’язання: За формулою обчислимо значення Періоду: Отже, Відповідь: частота коливань у контурі 160 МГц. V – ? 2. Дано: С = 1 мкФ = = 10-6 Ф U = 225 В L […]...
- Вправа 19 Вправа 19 1. Дано: S = 100 см2 = = 10-2 м2 В = 1 Тл α = 0° ?t = 0,01 с Розв’язання: Зміна магнітного поля спричинить ЕРС індукції, яка за законом електромагнітної індукції дорівнює За формулою? ф = ?В? S? cos α. Початковий магнітний потік ф1= BS cos α. Після зникнення магнітного поля […]...
- Вправа 20 Вправа 20 1. Дано: ε = 30 В Розв’язання: Згідно із законом ЕРС самоіндукції: Звідси Визначимо значення: Відповідь: індуктивність соленоїда 0,375 Гн. L – ? 2. Дано: L = 2 Гн ε= 20 В Розв’язання: Згідно із законом ЕРС самоіндукції: Звідси: Визначимо значення: Відповідь: швидкість зміни струму в обмотці електромагніту 3. Дано: ?І = 2А […]...
- Вправа 27 Вправа 27 1. Дано: α = 25° Розв’язання: Із закону відбивання світла β – α = 90° – β. Отже, 2β = 90°” + α; Відповідь: освітити дно криниці можна дзеркалом, яке поставлене під кутом 57,5° до горизонту. β-? 2. Плоске дзеркало має бути заввишки АВ – людина; А1В1 – зображення людини у дзеркалі; точка […]...
- Вправа 22 Вправа 22 1. Дано: Т = 1 кг Х = 30 см = 0,3 м G = 10 м/с2 Розв’язання: ω = 2πν = 2 · 3,14 · 1 Гц = 6,28 с-1. Відповідь: період 1 с, частота 1 Гц, колова частота 6,28 с-1 Т – ? V – ? ω – ? 2. Дано: […]...
- Вправа 65-72 № 65. Маса атома – важлива характеристика атома. Відносна атомна маса – маса атома елемента в порівнянні з 1/12 масою атома Карбону. № 67. Запис Аr – відносна атомна маса (а. о. м), Аг – символ елементу Аргону. № 68. Be → Аг = 9. Al → Аr =27. Легший атом Берилію у 3 рази. […]...
- Вправа 215-220 № 215. Ланки колообігу води в природі: – випаровування; – конденсація; – дощові опади; – участь у фотосинтезі; – поглинання коренями рослин з грунту. № 216. Технологічні процеси неможливі без води. Вода є: – розчинником; – теплоносієм; – охолоджувачем. № 218. № 219. № 220. Дано: Розв’язання 1. m(С) = 1 т = 1000 кг […]...
- Розрахунки за формулами для обчислення кількості речовини – Приклади розв’язування типових задач ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 1. Основні хімічні поняття. Речовина Приклади розв’язування типових задач І. Розрахунки за формулами для обчислення кількості речовини Формули і поняття, які використовуються: Де n(Х) – кількість речовини X, моль, M(Х) – маса речовини X, г, V(X) – об’єм газу X за нормальних умов, […]...
- Вправа 28 Вправа 28 1. Дано: V = 200 000 км/с = = 2 ? 108 м/с С = 3 ? 108 м/с Розв’язання: Показник заломлення Обчислимо значення: Відповідь: показник заломлення скла 1,5. N – ? 2. Дано: α = 25° V = 2,4 · 105 км/с = = 2,4 · 108 м/с С = 3 ? […]...
- Вправа 23 Вправа 23 1. Дано: I = 1м G = 10 м/с2 Розв’язання: За формулою періоду математичного маятника Маємо Відповідь: період коливань маятника ≈2 с. Т – ? 2. Дано: Т = 1с G = 10 м/с2 Розв’язання: Звідси Обчислимо значення: Відповідь: довжина маятника 25 см; частота 1 Гц. L – ? V – ? З. […]...
- Вправа 21 Вправа 21 1. А) Електричний струм, породжує магнітне поле, енергія якого переходить у механічну енергію; Б) в) енергія магнітного поля електромагніту переходить у механічну енергію; Г) енергія магнітного поля постійного магніту переходить у механічну енергію. 2. Дано: R = 8,2 Ом U = 55 В L = 25 мГн = = 25 ? 10-3Гн Розв’язання: […]...
- ОКСИГЕН І КИСЕНЬ. ПОШИРЕНІСТЬ ОКСИГЕНУ І КИСНЮ В ПРИРОДІ. ФІЗИЧНІ ВЛАСТИВОСТІ КИСНЮ № 1. Оксиген знаходиться у II періоді, VI групі періодичної системи, має порядковий номер № 8. Заряд ядра атому +8, має 8 електронів. Відносна атомна маса елементу Аг(O) = 16. Склад ядра атому: кількість протонів – 8, нейтронів – 8. № 2. Поширеність Оксигену і кисню в природі. Не існує жодного хімічного елемента, якого у […]...
- Визначення масової та об’ємної часток компонента в суміші – Приклади розв’язування типових задач ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 1. Основні хімічні поняття. Речовина Приклади розв’язування типових задач IV. Визначення масової та об’ємної часток компонента в суміші Формули і поняття, які використовуються: Де w(X) – масова частка цього компонента в суміші, Φ(Х) – об’ємна частка компонента X в суміші, M(X) – маса […]...
- Вправа 89-94 № 89. Коефіцієнт – цифра перед хімічною формулою, позначає кількість молекул речовини. 2O2 – дві молекули кисню; 3Сu – три атоми міді. Індекс – маленька цифра, записана нижче і справа від символу елементу. Показує кількість атомів елементів, які входять до складу молекули. Н2O – молекула води складається з 2 атомів Гідрогену і одного атому Оксигену. […]...
- Вправа 106-114 № 106. Відносна молекулярна маса – це відношення маси молекули до 1/12 маси атома Карбону. Її позначають Мr. Її розраховують за хімічною формулою (б). Маса дорівнює сумі відносних мас атомів, які містяться в молекулі. № 107. Найменшу відносну масу має речовина водень: Мr(Н2) = 2 • Аr(Н) = 2 • 1 = 2. № 108. […]...
- Вправа 29 Вправа 29 1. Дано: F = 25 см D = 25 см Розв’язання: За формулою лінзи Відповідь: фокусна відстань лінзи 12,5 см. F – ? 2. Дано: D = 60 см F = 50 см Розв’язання: За формулою лінзи звідси F = 300 см. Відповідь: зображення буде знаходитися на відстані 300 см. F – ? […]...
- Вправа 30 Вправа 30 1. Умова максимуму ?d = k? λ; ?d = 3 мкм. λ1 = 0,75 мкм; Умова максимуму виконується λ2 = 0,6 мкм; Умова максимуму виконується. λ3 = 0,5 мкм; Умова максимуму виконується. λ4 = 0,667 мкм; Умова максимуму не виконується. λ5 = 0,545 мкм; Умова максимуму не виконується. λ6 = 0,461 мкм; Умова […]...
- Обчислення відносної густини газу – Приклади розв’язування типових задач ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 1. Основні хімічні поняття. Речовина Приклади розв’язування типових задач III. Обчислення відносної густини газу Формули і поняття, які використовуються: Де Dnов.(X) – відносна густина газу X за повітрям, DA(X) – відносна густина газу X за газом А, М(Х) – молярна маса газу X, […]...
- Вправа 32 Вправа 32 1. Дано: R = 5,29 · 10-11 м L = 1,6 · 10-19 Кл ε0 = 8,85 · 10-12 Φ/м Розв’язання: Відповідь: Еп= -4,4 · 10-18 Дж; Еκ= 2,2 · 10-18 Дж; Е= -2,2 · 10-11 Дж Εκ – ? Εп – ? Ε – ? 2. Дано: ? Ε = 2,5 еВ […]...
- КИСЕНЬ У ПРИРОДІ – КИСЕНЬ Хімія – універсальний довідник КИСЕНЬ КИСЕНЬ У ПРИРОДІ Оксиген – найпоширеніший хімічний елемент на Землі. Повітря, що нас оточує, містить кисню 23% за масою і 21% за об’ємом. Ще більше Оксигену знаходиться у зв’язаному стані в земній корі – 47% за масою і 92% за об’ємом. У гідросфері – водах океанів, морів і т. д. […]...
- Вправа 165-173 № 165. Горіння – хімічна реакція, під час якої виділяється теплота і з’являється полум’я. Умови: 1) наявність кисню; 2) нагрівання речовини до температури самозаймання. № 166. Не можна, тому що ознака горіння – наявність полум’я. Горіння відбувається за умови наявності кисню, але в електролампочці його немає. № 167. Способи гасіння полум’я: 1) водою (крім бензину, […]...
- Вправа 11 Вправа 11 1. Дано: С = 200 мкФ = 2 ? 10-4 Ф?φ = 1000 В Розв’язання: Енергія конденсатора визначається за формулою: Перевіримо одиниці фізичних величин: Підставимо числові значення: Відповідь: енергія конденсатора 100 Дж. W – ? 2. Дано: Q = 4,8 ? 10-3 Кл ?φ = 600 В Розв’язання: Енергія конденсатора визначається за формулою: […]...
- Вправа 7 Вправа 7 1. Дано: φ = 6 ? 103 В Q = 3 ? 10-8 Кл Розв´язання: Відповідно до означення електроємність кульки Перевіримо одиниці фізичних величин: Підставимо числові значення: Відповідь: електроємність кульки 5 пФ. С – ? 2. Дано: φ = 30 В С = 150 пФ = = 150 ? 10-12 Ф Розв’язання: Відповідно […]...