Вправа 156-164
№ 156.
Реакції сполучення | Реакції розкладу |
1. Беруть участь кілька речовин | 1. Бере участь одна речовина |
2. Утворюється одна речовина | 2. Утворюється кілька інших речовин |
Приклади | |
|
|
№ 157.
Формули оксидів: Н2O, І2O5, ВаО.
№ 158.
1) – в |
|
2) |
|
3) – б |
|
№ 159.
NO – нітроген(ІІ) оксид;
Ті2O3 – титан(ІІІ) оксид;
Сu2O – купрум(І) оксид;
Сl2O7 – хлор(VІІ) оксид;
V2O5 – ванадій(V) оксид;
СrO3 – хром(VІ) оксид.
№ 160.
Плюмбум(ІV) оксид – РbO2;
Хром(ІІІ) оксид – Сr2Оа;
Хлор(І) оксид – Сl2O;
Осмій(VІІІ) оксид – OsO4.
№ 161.
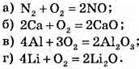
№ 162.
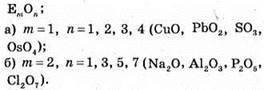
№ 163.

Відповідь: ω(O) = 68,6%.
№ 164.
1) 2Mg + O2 = 2MgO – тверда речовина, кисень використався на окиснення магнію;
2) S + O2 = SO2↑ – утворився газ, який заповнив колбу, тому вакуум утворився у першій колбі.
Related posts:
- ХІМІЧНІ ВЛАСТИВОСТІ КИСНЮ. РЕАКЦІЯ СПОЛУЧЕННЯ № 1. Оксиди – бінарні сполуки елементів з Оксигеном. Формули оксидів – Na2O, CuO, ZnO. № 2. ВЗАЄМОДІЯ КИСНЮ З ПРОСТИМИ РЕЧОВИНАМИ. 1. Взаємодія з вуглецем С + O2 = СO2 – вуглекислий газ, або карбон (IV) оксид 2. Взаємодія з воднем 2Н2 + О2 = 2Н2O – вода або гідроген оксид 3. Взаємодія а […]...
- Вправа 146-152 № 146. Добування кисню у промисловості: 1. З повітря: – охолодження повітря і перетворення його на рідину; – підвищення температури та виділення газу азоту, потім кисню. № 147. Реакції розкладу – це реакції, під час яких із однієї речовини утворюється кілька інших. № 148. № 149. Каталізатор – речовина, яка спричиняє перебіг реакції або прискорює […]...
- Хімічні властивості кисню Контрольні запитання № 1. Хімічні властивості кисню. Взаємодія кисню з простими речовинами. 1. Взаємодія з вуглецем. С + O2 = СO2 – вуглекислий газ або карбон(ІV) оксид 2. Взаємодія з воднем. 2Н2 + O2 = 2Н2O – вода або гідроген оксид 3. Взаємодія з сіркою. S + O2 = SO2 – сірчистий газ, або сульфур(IV) […]...
- Вправа 139-145 № 139. Хімічне рівняння – це запис хімічної реакції за допомогою формул реагентів і продуктів, який відповідає закону збереження маси речовин. № 140. № 141. № 142. № 143. № 144. № 145. Дано: Розв’язання 1. Запишемо рівняння реакції: Згідно із законом збереження маси речовин під час хімічної реакції, маса речовин, що вступила в реакцію, […]...
- Вправа 73-82 № 73. Проста речовина – речовина, утворена одним хімічним елементом. Сірка, цинк, мідь, графіт. № 74. Прості речовини: метали і неметали. № 75. Б). № 76. Фізичні властивості металів: – твердість; – електропровідність; – теплопровідність; – висока температура плавлення; – пластичність, ковкість. № 77. А) азот; б) азоту, Нітрогену; в) Нітрогену; г) азот. № 78. […]...
- Вправа 89-94 № 89. Коефіцієнт – цифра перед хімічною формулою, позначає кількість молекул речовини. 2O2 – дві молекули кисню; 3Сu – три атоми міді. Індекс – маленька цифра, записана нижче і справа від символу елементу. Показує кількість атомів елементів, які входять до складу молекули. Н2O – молекула води складається з 2 атомів Гідрогену і одного атому Оксигену. […]...
- Хімічні властивості кисню: реакції з простими речовинами. Оксиди Розділ 2 Кисень 21 Хімічні властивості кисню: реакції з простими речовинами. Оксиди Матеріал параграфа допоможе вам: > оцінити здатність кисню вступати в реакції з металами і неметалами; > з’ясувати, що таке реакція сполучення і які сполуки називають оксидами; > навчитися складати формули оксидів і називати ці сполуки. Хімічні властивості кожної речовини виявляються в хімічних реакціях […]...
- Вправа 57-64 № 57. Хімічний елемент – вид атомів із певним зарядом ядра. Хімічний елемент – не атом і не речовина. Він не має агрегатного стану, густини, інших фізичних властивостей. № 58. Короткий варіант – має 7 груп, 11 рядів; – має 8 періодів. Довгий варіант – має 7 груп, 7 рядів; – має 18 періодів (Іа, […]...
- Сполуки Феруму (IІI) – Ферум ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 8. Металічні елементи та їхні сполуки. Метали 8.5. Ферум 8.5.2. Сполуки Феруму ( III ) Ферум(ІІІ) оксид Fe2О3 – найстійкіша природна спорка Феруму, порошок бурого кольору, має атомні кристалічні гратки, у воді не розчиняється. Ферум(ІІІ) оксид виявляє слабкі амфотерні властивості (з переважанням основних) […]...
- Добування оксидів – ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК Добування оксидів Із простих речовин Найбільш простий спосіб добування оксидів – це взаємодія простих речовин з киснем: Майже всі прості речовини взаємодіють із киснем. Багато з них взаємодіють досить бурхливо, з виділенням великої кількості теплоти й світла, тобто горять. […]...
- Вправа 215-220 № 215. Ланки колообігу води в природі: – випаровування; – конденсація; – дощові опади; – участь у фотосинтезі; – поглинання коренями рослин з грунту. № 216. Технологічні процеси неможливі без води. Вода є: – розчинником; – теплоносієм; – охолоджувачем. № 218. № 219. № 220. Дано: Розв’язання 1. m(С) = 1 т = 1000 кг […]...
- Приклади розв’язування типових задач – Урок 3 ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 3. Хімічний зв’язок Приклади розв’язування типових задач Задача 1. Укажіть кількість р-електронів, які утворюють хімічні зв’язки у молекулі хлор(І) оксиду. Розв’язання Сl2O. Будова електронних оболонок елементів Хлору і Оксигену: З формули видно, що Хлор перебуває в основному (незбудженому) стані та виявляє валентність І. […]...
- Хімічні елементи – Біологічно важливі речовини – Загальна Біологія Біологія Загальна Біологія Біологічно важливі речовини Хімічні елементи За кількісним розподілом у клітинах хімічні елементи можна розподілити на три групи. Макроелементи (уміст понад 0,01 %): Карбон, Гідроген, Оксиген, Нітроген, Фосфор, Сульфур, Натрій, Кальцій, Калій, Магній, Хлор. Мікроелементи : Ферум, Цинк, Манган, Кобальт, Купрум, Флуор, Йод. Ультрамікроелементи (менше %): Бор, Літій, Алюміній, Силіцій, Олово, Кадмій, Арсен, […]...
- Ферум. Оксиди й гідроксиди Феруму – Метали Хімія Неорганічна хімія Метали Ферум. Оксиди й гідроксиди Феруму Ферум Елемент Ферум Розташований в VIIIБ групі (VIII групі, побічній підгрупі), у 4 періоді. Електронна конфігурація атома Феруму: Валентними у Феруму є електрони як останнього, так і передостаннього рівня d-підрівня. Найхарактерніші ступені окиснення у сполуках +2 і +3. Ферум – другий за поширеністю в природі метал […]...
- Тести – Урок 4 – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція Тести 4.1 Установіть відповідність реагентів з типом реакції, що між ними відбувається Реагенти: Тип реакції: 1 магній оксид і нітратна кислота А сполучення 2 магній і хлор Б заміщення 3 магній і хлоридна кислота В обмін 4 магній нітрид і […]...
- Хром – МЕТАЛИ ПОБІЧНИХ ПІДГРУП ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ Частина II. НЕОРГАНІЧНА ХІМІЯ Розділ 14. МЕТАЛИ ПОБІЧНИХ ПІДГРУП § 14.2. Хром Поширення у природі. Хром трапляється у вигляді сполук у різних мінералах. Найпоширеніший мінерал хроміт, або хромистий залізняк FeCr2O4, багаті родовища якого є на Уралі і в Казахстані. Загальний вміст хрому в земній корі становить […]...
- Проміжне оцінювання з теми “Фізичні й хімічні властивості оксидів і кислот” Тема 2 ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК УРОК 21 Тема. Проміжне оцінювання з теми “Фізичні й хімічні властивості оксидів і кислот” Цілі уроку: узагальнити й систематизувати знання учнів про класифікацію неорганічних сполук, фізичні й хімічні властивості оксидів і кислот; визначити рівень навчальних досягнень учнів з цієї теми. Тип уроку: контроль і коригування знань. Форми роботи: письмова […]...
- Зміна концентрації – Чинники, що впливають на зміщення хімічної рівноваги ХІМІЧНА РІВНОВАГА 2 . Чинники, що впливають на зміщення хімічної рівноваги 2.3 . Зміна концентрації У випадку зміни концентрації однієї речовини в зрівноваженій системі змінюються концентрації всіх інших речовин. Раніше наголошувалося, що стан рівноваги залежить від температури та тиску, зміна концентрації речовин викличе зміщення рівноваги і система намагатиметься відновити стан рівноваги. В реакції рівноваги А […]...
- РЕАКЦІЇ СПОЛУЧЕННЯ – ТИПИ ХІМІЧНИХ РЕАКЦІЙ Хімія – універсальний довідник ТИПИ ХІМІЧНИХ РЕАКЦІЙ РЕАКЦІЇ СПОЛУЧЕННЯ Уже сама назва “реакція сполучення” говорить про її тип. У результаті сполучення декількох речовин утворюється одна нова речовина. Практично завжди в реакцію сполучення вступає не більше двох речовин; ці речовини можуть бути як простими, так і складними. Приклади реакцій сполучення: У переважній більшості реакції сполучення є […]...
- ДОБУВАННЯ ТА ЗБИРАННЯ КИСНЮ. ПОНЯТТЯ ПРО КАТАЛІЗАТОРИ. РЕАКЦІЯ РОЗКЛАДУ № 1. Каталізаторами називають речовини, які прискорюють хімічні реакції інших речовин, але при цьому самі не витрачаються і не входять до складу утворених продуктів реакції. Тому їхні формули не пишуть ні в лівій, ні в правій частині рівнянь хімічних реакцій. Кисень добувають з розчину гідроген пероксиду Н2O2. Для прискорення реакції додають невелику кількість манган (IV) […]...
- Нітроген(IV) оксид – Елементи VA групи ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ II. НЕОРГАНІЧНА ХІМІЯ 9. Неметалічні елементи та їхні сполуки. Неметали 9.4. Елементи VA групи 9.4.5. Нітроген( IV ) оксид Нітроген утворює п’ять оксидів зі ступенями окиснення +1, +2, +3, +4 і +5. Нітроген(ІV) оксид, нітроген діоксид NO2 за стандартних умов – це газ бурого кольору1 з […]...
- Киснева корозія – Корозія ОКИСНЕННЯ І ВІДНОВЛЕННЯ 2 . Корозія 2.2. Киснева корозія Залізо – один із найважливіших матеріалів, який, на жаль, має здатність іржавіти на вологому повітрі. На першому етапі в процесі окисно-відновної реакції залізо окислюється, а кисень повітря відновлюється. Окиснення: Відновлення: Іони Феруму, що утворюються під час окисно-відновної реакції і гідроксид-іони рухливі та вступають у реакцію між […]...
- Класифікація хімічних реакцій – ХІМІЧНІ РЕАКЦІЇ ТА ЗАКОНОМІРНОСТІ ЇХ ПЕРЕБІГУ Хімія підготовка до ЗНО та ДПА Комплексне видання ЧАСТИНА І ЗАГАЛЬНА ХІМІЯ ХІМІЧНІ РЕАКЦІЇ ТА ЗАКОНОМІРНОСТІ ЇХ ПЕРЕБІГУ Класифікація хімічних реакцій Класифікація за числом та складом вихідних реагентів і продуктів реакції Реакція сполучення – реакція, внаслідок якої з кількох речовин з відносно простим складом утворюється одна велика речовина з більш складною структурою. А + В […]...
- НАЙВАЖЛИВІШІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК ПОВТОРЕННЯ ПИТАНЬ КУРСУ ХІМІЇ ОСНОВНОЇ ШКОЛИ УРОК 1. НАЙВАЖЛИВІШІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК Цілі: повторити склад, властивості, добування оксидів, кислот, основ і солей; формувати вміння складати формули основних класів сполук і рівняння, що характеризують їх властивості й добування. Обладнання: роздавальний матеріал, мультимедійний проектор, комп’ютер. Тип уроку: узагальнювальне повторення. Форми роботи: робота в групах, прийоми “Хімічний диктант”, […]...
- Вправа 106-114 № 106. Відносна молекулярна маса – це відношення маси молекули до 1/12 маси атома Карбону. Її позначають Мr. Її розраховують за хімічною формулою (б). Маса дорівнює сумі відносних мас атомів, які містяться в молекулі. № 107. Найменшу відносну масу має речовина водень: Мr(Н2) = 2 • Аr(Н) = 2 • 1 = 2. № 108. […]...
- Вправа 41-45 № 41. Типи сумішей Однорідні – суміші, компоненти яких неможливо виявити шляхом спостереження. Неоднорідні – суміші, компоненти яких можна виявити шляхом спостереження: – піна (рідина і газ) – емульсія (рідина і рідина) – суспензія (рідина і тверда речовина) – аерозоль (газ і газ) № 42. Чисті речовини – алюміній – ртуть – лід із джерельної […]...
- Ентропія реакції – Рушійна сила хімічних реакцій ЕНЕРГЕТИКА ХІМІЧНИХ РЕАКЦІЙ 3. Рушійна сила хімічних реакцій 3.3. Ентропія реакції У кожній реакції впорядкований стан системи змінюється і, отже, змінюється ентропія. Зміна ентропії реакції ∆SR, як і ентальпії реакції, визначається як різниця суми ентропій продуктів реакції і суми ентропій початкових речовин: Приклад. Під час реакції газоподібного гідроген хлориду з газоподібним амоніаком з двох “невпорядкованих” […]...
- Вправа 131-138 № 131. А) Кисень – проста речовина Оксигена; Б) вода утворена Гідрогеном і Оксигеном; В) молекула кисню складається із двох атомів Оксигену; Г) у результаті фотосинтезу рослини поглинають вуглекислий газ, а виділяють кисень. № 132. У повітрі найбільше газів: – азот N2 – 78,08 %; – кисень O2 – 20,95 %. № 133. Атоми Оксигену […]...
- Доменне виробництво чавуну – Метали Хімія Неорганічна хімія Метали Доменне виробництво чавуну Чавун – сплав заліза з вуглецем та іншими домішками (силіцієм, манганом, сіркою, фосфором). Масова частка Карбону в чавуні понад 1,7 % (до 4,5 %). Доменний процес Суть доменного процесу – відновлення заліза з його природних оксидів. Виплавка чавуну відбувається в доменних печах (домнах). Склад вихідної суміші (ШихтИ): 1) […]...
- Типи хімічних реакцій – Хімічна реакція ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ 4. Хімічна реакція 4.3. Типи хімічних реакцій Хімічні реакції класифікують за різними ознаками: – за фазовим станом середовища; – за типом перетворення реагентів; – за тепловим ефектом; – за ознакою зміни ступенів окиснення; – за оборотністю. Фазовий стан середовища Залежно від фазового стану […]...
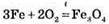
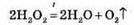
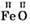 – ферум(ІІ) оксид
– ферум(ІІ) оксид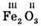 – ферум(ІІІ) оксид
– ферум(ІІІ) оксид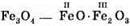 – ферум(II, III) оксид
– ферум(II, III) оксид