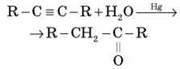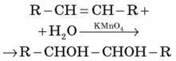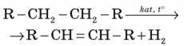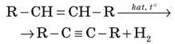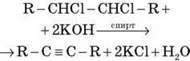Хімічні властивості алкенів: повне й часткове окиснення, приєднання водню, галогенів, гідрогенгалогенідів, води, полімеризація. Правило В. В. Марковнікова, механізм реакції приєднання за подвійним зв’язком. Одержання й використання алкенів
І СЕМЕСТР
Тема 2. ВУГЛЕВОДНІ
Урок 13
Тема уроку. Хімічні властивості алкенів: повне й часткове окиснення, приєднання водню, галогенів, гідрогенгалогенідів, води, полімеризація. Правило В. В. Марковнікова, механізм реакції приєднання за подвійним зв’язком. Одержання й використання алкенів
Цілі уроку: формувати в учнів знання про хімічні властивості алкенів; розкрити хімічні властивості ненасичених вуглеводнів на прикладі етену та його гомологів, його взаємодію з розчинами кислот, лугів, калій перманганату; формувати знання
Тип уроку: вивчення нового матеріалу.
Форми роботи: самостійна робота, навчальна лекція, демонстраційний експеримент.
Демонстрація 5. Горіння етену, взаємодія з бромною водою, розчином калій перманганату.
Обладнання: моделі молекул вуглеводнів.
ХІД УРОКУ
I. Організація класу
II. Перевірка
Актуалізація опорних знань.
Мотивація навчальної діяльності
1. Самостійна робота
Варіант І
1. Напишіть рівняння реакцій, з допомогою яких можна здійснити схему перетворень:
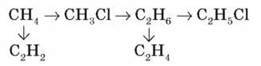
2. Обчисліть об’єм кисню (н. у), що потрібен для спалювання 8,8 г пропану.
(Відповідь: 11,2 л)
Варіант ІІ
1. Напишіть рівняння реакцій, з допомогою яких можна здійснити схему перетворень:
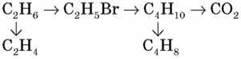
2. Обчисліть об’єм водню (н. у.), що виділиться в результаті дегідрування 7,8 г бутану.
(Відповідь: 2,24 л)
2. Фронтальна бесіда
¦ Наведіть загальні формули гомологічних рядів алканів, алкенів, алкінів.
¦ Назвіть види гібридизації атомів Карбону в молекулах етану, етену, етину.
¦ Якими видами хімічного зв’язку утворені молекули етану, етену, етину?
¦ Порівняйте види ізомерії в алканів та алкенів на прикладі бутану й бутену. (Двоє учнів біля дошки записують формули й назви ізомерів.)
¦ Які вуглеводні (алкени чи алкани) частіше трапляються в природі? Назвіть найпоширеніші сполуки.
III. Вивчення нового матеріалу
ХІМІЧНІ ВЛАСТИВОСТІ АЛКЕНІВ
1. Демонстрація 5. Одержання й горіння етилену
1) Одержання етилену шляхом дегідратації етанолу в присутності концентрованої сульфатної кислоти:
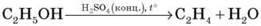
2) Горіння етилену.
2. Способи одержання алкенів
3. Хімічні властивості алкенів
1) Галогенування
Алкени за звичайних умов приєднують галогени, утворюючи дигалогенопохідні алкани, що містять атоми галогену біля сусідніх атомів Карбону.
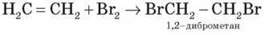
Демонстрація 5. Взаємодія ненасичених вуглеводнів з розчинами кислот, лугів, калій перманганату Взаємодія етилену з бромною водою й калій перманганатом:
CH2 = CH2 + Br2 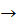 CH2Br – CH2Br
CH2Br – CH2Br
(Рівняння реакції записуємо в зошит.)
Висновок: ненасичені вуглеводні знебарвлюють розчин калій перманганату і бромну воду.
! Реакція з бромною водою (Br2) – якісна реакція на наявність кратного зв’язку!
Наведена реакція – знебарвлення алкеном бромної води – є якісною реакцією на подвійний зв’язок.
2) Гідрування
Алкени легко приєднують водень у присутності каталізаторів (Pt, Pd, Ni), утворюючи насичені вуглеводні.
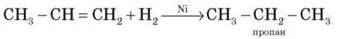
3) Гідрогалогенування
Етилен та його гомологи приєднують галогеноводні, утворюючи галогенопохідні вуглеводнів.
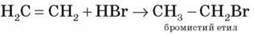
Приєднання галогеноводнів до пропілену та інших алкенів відбувається відповідно до правила В. В. Марковнікова (водень приєднується до найбільш гідрогенізованого атома Карбону в місці подвійного зв’язку).
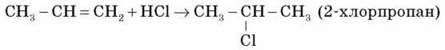
4) Гідратація
У присутності мінеральних кислот олефіни приєднують воду, утворюючи спирти.

5) Окиснення
Алкени легко окислюються. Залежно від умов проведення реакції утворюються різні продукти.
А) У результаті спалювання на повітрі олефіни дають вуглекислий газ і воду:
H2C = CH2 + 3O2 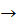 2CO2 + 2H2O
2CO2 + 2H2O
Б) У разі окиснення алкенів розведеним розчином калій перманганату утворюються двохатомні спирти – гліколі (реакція Є. Є. Вагнера). Реакція відбувається на холоді:

У результаті реакції спостерігається знебарвлення розчину калій перманганату. Реакція Вагнера є якісною пробою на подвійний зв’язок.
В) У процесі жорсткого окиснення алкенів киплячим розчином калій перманганату в кислому середовищі відбувається остаточний розрив подвійного зв’язку й утворення кислот або кетонів.
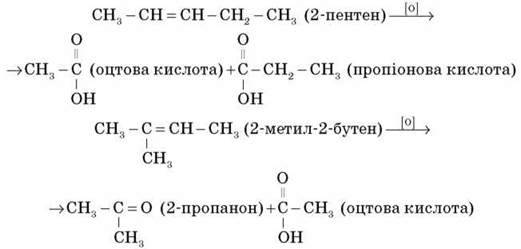
За продуктами, що утворилися (кислотами й кетонами), можна зробити висновок про будову і склад радикалів, пов’язаних з етиленовим угрупованням у вихідній сполуці. До широкого впровадження спектральних методів ідентифікації органічних сполук ця реакція повсюдно використовувалася для визначення будови невідомих алкенів.
6) Реакція полімеризації
Однією з найбільш важливих у практичному плані реакцій ненасичених сполук (або олефінів) є полімеризація. Реакцією полімеризації називається процес утворення високомолекулярної сполуки (полімеру) шляхом з’єднання одна з одною молекул вихідної низькомолекулярної сполуки (мономера). Під час полімеризації подвійні зв’язки в молекулах вихідної ненасиченої сполуки “розкриваються”, і за рахунок вільних валентностей, що утворюються, ці молекули з’єднуються одна з одною.
Полімеризація олефінів спричиняється нагріванням, тиском, опроміненням, дією вільних радикалів або каталізаторів. У спрощеній формі що реакцію на прикладі етилену можна представити так:
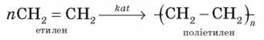
Залежно від механізму реакції існує два види полімеризації:
1) радикальна, або ініційована;
2) іонна, або каталітична.
Додаткові способи одержання
А. Алкенів
1. Гідрування алкінів:
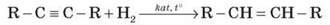
2. Дегідратація спиртів (відщеплення води):

Б. Ацетилену
1. Крекінг метану:
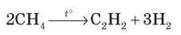
2. Карбідний метод:
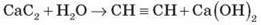
Одержання карбіду:

4. Застосування алкенів
Алкени широко використовуються в промисловості як вихідні речовини для одержання розчинників (спиртів, дихлоретану, естери гліколей тощо), полімерів (поліетилену, полівінілхлориду, поліізобутилену та ін.), а також багатьох інших дуже важливих продуктів.
Етилен (етен) H2C = CH2 використовується для одержання поліетилену, політетрафлуоретилену (тефлону), етилового спирту, оцтового альдегіду, галогенопохідних і багатьох інших органічних сполук.
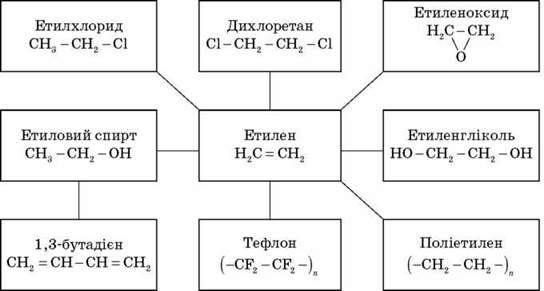
Застосовується як засіб для прискореного дозрівання фруктів. Пропілен (пропен) H2C = CH2 – CH3 і бутилени (бутен-1 і бутен-2) використовуються для одержання спиртів і полімерів.
Ізобутілен (2-метилпропен) H2C = C(CH3)2 застосовується у виробництві синтетичного каучуку.
IV. Первинне застосування одержаних знань
1. Складання загальної схеми, що характеризує властивості алкенів
Хімічні властивості | Алкени | Алкіни |
1. Реакція горіння | СnH2n + O2 | СnH2n-2 + O2 |
2. Гідрування (приєднання H2) |
|
|
| ||
3. Галогенування (приєднання Сl2, Br2) | R – CH = CH – R + Cl2 | R – C |
R – C | ||
4. Гідрогалогенування (приєднання НСl, НВr) | R – CH = CH – R + HCl | R – C |
5. Гідратація (приєднання води) | R – CH = CH – R + H2O (H – OH) | Реакція Кучерова:
|
|
Загальні способи одержання | Алкени | Алкіни |
1. Дегідрування | Алканів:
| Алкенів:
|
2. Відщеплення НСl |
|
|
3. Відщеплення Cl2 | R – CHCl – CHCl – R + Zn | R – CCl2 – CCl2 – R + 2Zn |
2. Тренувальні вправи
¦ Запишіть рівняння реакцій, що характеризують хімічні властивості етилену й ацетилену:
А) гідрування;
Б) бромування;
В) взаємодії з бромоводнем;
Г) гідратації.
¦ Поясніть, яка властивість ацетилену використовується під час зварювання металів.
¦ У результаті згоряння вуглеводню масою 5,6 г утворилося 8,96 л карбон(IV) оксиду (н. у.) і 7,2 г води. Відносна густина цього вуглеводню за воднем дорівнює 14. Визначте формулу вуглеводню.
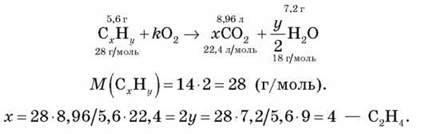
¦ У результаті згоряння вуглеводню масою 6,5 г утворилося 11,2 л карбон(IV) оксиду (н. у.) і 4,5 г води. Відносна густина вуглеводню за воднем дорівнює 13. Визначте формулу вуглеводню.
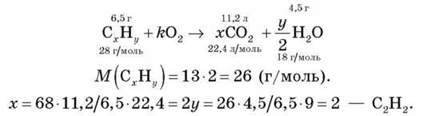
¦ Порівняйте масову частку Карбону в ацетилені й етилені.
V. Підбиття підсумків уроку
1. Фронтальна бесіда
1) Назвіть загальні хімічні властивості алкенів і алканів.
2) Назвіть відмітні хімічні властивості насичених і ненасичених вуглеводнів.
3) Який клас вуглеводнів є найбільш хімічно активним?
4) Яку реакцію можна використати для виявлення етану й етину?
5) Яка властивість ацетилену використовується під час зварювання металів?
2. Оцінювання роботи учнів на уроці
VI. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи.



 C – R + Cl2
C – R + Cl2