Загальні хімічні властивості неметалів
I СЕМЕСТР
Тема 1. НЕМЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ (18 год.)
УРОК 7
Тема уроку. Загальні хімічні властивості неметалів
Цілі уроку: розвивати й поглиблювати знання учнів про неметали на прикладі їхніх хімічних властивостей (взаємодії з киснем, воднем, металами); розвивати навички й уміння порівнювати хімічні властивості різних речовин на прикладі сполук Сульфуру, Нітрогену, Фосфору, Карбону, Силіцію, складати окисно-відновні рівняння, знаходити взаємозв’язок між будовою та властивостями речовин; показати на прикладах загальні
Тип уроку: комбінований урок засвоєння знань, умінь і навичок і творчого застосування їх на практиці.
Форми роботи: фронтальна бесіда з теми, навчальна лекція, робота з опорною схемою, демонстраційний експеримент.
Обладнання: періодична таблиця хімічних елементів, таблиця розчинності.
Демонстрація 1. Взаємодія заліза із сіркою.
ХІД УРОКУ
І. Організація класу
ІІ. Перевірка домашнього завдання, актуалізація опорних знань
Фронтальна
1) Наведіть приклади явища алотропії в природі.
2) Чим відрізняються алотропні модифікації Оксигену? Карбону? Сульфуру?
3) Запишіть ОВР взаємодії сірки, азоту, фосфору, вуглецю, силіцію з киснем, укажіть окисник і відновник (два-три учні біля дошки).
4) Який висновок можна зробити про умови перебігу цих хімічних реакцій? Чому вони відрізняються?
ІІІ. Вивчення нового матеріалу
Загальні хімічні властивості неметалів
Неметали можуть проявляти як окисні, так і відновні властивості.
1. Окисні властивості неметали проявляють у взаємодії з металами
1) Сірка з металами утворює солі – сульфіди.
Як і кисень, реагує з усіма металами, крім Au, Pt, Ir. Ці реакції протікають за умови нагрівання, але в деяких випадках і за звичайної температури.
З кобальтом і ртуттю сірка вступає в реакцію вже за звичайних умов (потовкти в ступці):
Hg + S  HgS
HgS
Демонстрація 1. Взаємодія заліза із сіркою
Із залізом сірка взаємодіє в процесі нагрівання:
Fe + S  FeS + Q (суміш розжарюється в результаті реакції).
FeS + Q (суміш розжарюється в результаті реакції).
З алюмінієм і цинком – у результаті підпалювання (окисний спалах):
2Al + 3S  Al2S3
Al2S3
Zn + S  ZnS
ZnS
З міддю – у парах сірки:
2Cu + S  Cu2S (утворюється чорний порошок).
Cu2S (утворюється чорний порошок).
Сульфіди за деякими властивостями подібні до оксидів – основних (Na2S, MgS), амфотерних (Al2S3, Cr2S3) і кислотних (MoS, WS3).
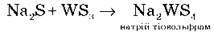 (аналогічно до Na2SO4)
(аналогічно до Na2SO4)
2) У результаті взаємодії азоту й фосфору з металами утворюються нітриди й фосфіди.
З магнієм реакція протікає легко:
2P + 3Mg = Mg3P2
Аналогічно протікає реакція з кальцієм з утворенням кальцій фосфіду Ca3P2 (напишіть рівняння цієї реакції).
З магнієм – під час нагрівання:
N2 + 3Mg  Mg3N2
Mg3N2
3) Вуглець у результаті взаємодії з металами утворює карбіди:
2C + Ca  CaC2
CaC2
3C + 4Al  Al4C3
Al4C3
Силіцій – силіциди:
Si + 2Mg  Mg2Si
Mg2Si
2. Окисні властивості неметалів під час взаємодії з воднем За звичайних умов сірка з воднем не реагує. У разі нагрівання (пропускають водень над киплячою сіркою) протікає реакція:
H2 + S 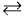 H2S + 20,92 кДж
H2S + 20,92 кДж
(Гідроген сульфід, що виділяється при цьому, має характерний запах гнилих яєць.)
Взаємодія азоту з воднем описується рівнянням:
N2 + 3H2 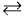 2NH3 + Q
2NH3 + Q
Реакція гомогенна, екзотермічна, оборотна, каталітична.
NH3 – амоніак – безбарвний газ із різким запахом, розчинний у воді (за температури 20 °С – ~ 700V NH3). Тпл = -77,7 °С, Ткип = -33,4 °С.
Фосфор з воднем практично не взаємодіють. Однак, у процесі розкладання деяких солей можна одержати фосфін:
Ca3P2 + 6Н2О  3Ca (ОН) + 2PH3
3Ca (ОН) + 2PH3
Також фосфін можна одержати з фосфору:
Р4 + 3NaОH + 3Н2О  3NaH2PО3 + PH3
3NaH2PО3 + PH3
PH3 – безбарвний газ із запахом “гнилої риби”, отруйний, з водою не взаємодіє, Тпл = -133 °С, Ткип = -87,4 °С.
Вуглець із воднем взаємодіє з утворенням метану:
C + 2Н2  CH4
CH4
Силіцій – з утворенням силану:
Si + 2Н2  SiH4
SiH4
Силан менш стійкий, ніж метан, на повітрі мимовільно окислюється:
SiH4 + 2О2  SiО2 + 2H2О
SiО2 + 2H2О
3. Відновні властивості проявляються у взаємодії з киснем і галогенами
За нормальних умов сірка з киснем не взаємодіє. У разі нагрівання на повітрі згоряє блакитним, а в чистому кисні – синім полум’ям:
S + О2  SО2 (утворюється сульфур(IV) оксид, безбарвний газ із різким запахом).
SО2 (утворюється сульфур(IV) оксид, безбарвний газ із різким запахом).
Взаємодія азоту з киснем відбувається за високої температури в присутності каталізатора за схемою:
N2 + О2 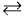 2N0
2N0
Така реакція в природі відбувається під час грозових розрядів.
У результаті взаємодії фосфору з O2 утворюються різні продукти. У надлишку O2 (повітря) утворюється P2O5 – фосфорний ангідрид, у разі нестачі O2 – P2O3 (фосфористий).
Дайте назву одержаним оксидам і кислотам за сучасною номенклатурою.
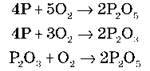
*Реакція окиснення фосфору супроводжується світінням, тому що паралельно з окисненням відбувається утворення озону:
P + O2  PO + O (РО – фосфорил)
PO + O (РО – фосфорил)
O + O2  O3
O3
Хемілюмінесценція (виділення проміжних продуктів – НРО) – приклад перетворення енергії окиснення на світлову енергію.
Вуглець на повітрі згоряє:
C + O2  CO2 + 402 кДж
CO2 + 402 кДж
Деревне вугілля горить без полум’я й диму, тому що не містить горючих летких речовин. Найбільш реакційно-здатними є сажа й вугілля, найменш – алмаз.
Алмаз і графіт згоряють у чистому кисні за температури 700800 °С.
Силіцій горить у кисні за температури 500 °С:
Si + O2  SiO2
SiO2
Сірка, вуглець, силіцій взаємодіють з галогенами (не реагують з I2), наприклад:
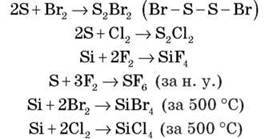
4. Вуглець і силіцій проявляють відновні властивості під час взаємодії з оксидами металів
C + 2CuO  2Cu + CO2
2Cu + CO2
5. Силіцій взаємодіє з вуглецем і сіркою
Si + 2S  SiS2 (за 500 °С)
SiS2 (за 500 °С)
Si + C  SiC
SiC
SiC – карборунд (твердий, гратка алмаза).
6. Неметали взаємодіють з кислотами й лугами
Наприклад, сірка взаємодіє з кислотами:
3S + 6HNO3  3H2SO4 + 6NO
3H2SO4 + 6NO
І лугами з утворенням двох солей:
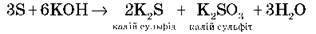
На силіцій кислоти не діють, а з лугами реакція відбувається за схемою:
Si + 2NaOH + H2O  Na2SiO3 + 2H2
Na2SiO3 + 2H2
IV. Тренувальні вправи
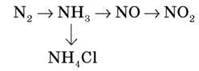
Завдання 1. Здійсніть перетворення.
Завдання 2. Обчисліть об’єм метану (н. у.), який можна одержати в результаті каталітичного синтезу зі 120 г вуглецю й 480 л водню, якщо вихід продукту реакції становить 95 %?
Завдання 3. Здійсніть перетворення.
S  SO2
SO2  SO3
SO3  H2SO4
H2SO4  Na2SO4
Na2SO4
Завдання 4. Напишіть рівняння реакцій взаємодії вуглецю з флу – ором, сіркою, ферум(ІІІ) оксидом. Укажіть окисник і відновник.
Завдання 5. Обчисліть об’єм повітря, який необхідно витратити на каталітичне окиснення азоту об’ємом 67,2 л (н. у.).
V. Підбиття підсумків уроку
1) У чому полягає подібність хімічних властивостей Сульфуру, Нітрогену, Карбону?
2) У чому полягають відмінності між хімічними властивостями Сульфуру, Нітрогену, Карбону?
3) Чи однаково взаємодіють з киснем алотропні модифікації Сульфуру й Карбону?
4) чому силіцій, вуглець, сірка взаємодіють між собою, а з азотом – ні?
VI. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи.
Творче завдання: підготувати повідомлення про хімічні властивості озону.