Збуджений стан атома – Електрон. Електронні шари
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ
2. Будова атома
2.4. Електрон. Електронні шари
2.4.2. Збуджений стан атома
При збудженні атомів електрони набувають більшої енергії, відбувається перехід електронів з нижчих енергетичних підрівнів на вищі. Так, в атома Сульфуру є вільні d-орбіталі, тому можливий перехід одного зі спарених електронів з 3p-орбіталі (рх) на вакантну 3<і-орбіталь (перший збуджений стан – S*):
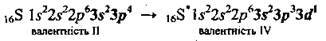
А при подальшому збудженні –
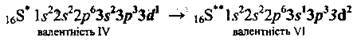
Електронна будова деяких атомів великих періодів має певні особливості. Так, у Калію 19-й електрон розміщується не на 3d-підрівні, а на 4s-підрівні, що виявляється енергетично більш вигідним: 19К…3s23p63d04s1. В атома Кальцію 4s-підрівень завершується: 4s2. Оскільки енергія 3d-електронів нижча за енергію 4р-елекгронів, заповнення 3d-підрівня починається тільки зі Скандію: 21Sс…3s23p63d14s2. У наступних за Скандієм елементів – Титану (Ті), Ванадію (V), Хрому (Сr), Мангану (Мn), Феруму (Fe), Кобальту (Co), Ніколу (Nі), Купруму
Елементи з порядковими номерами від 21 до 36 називають перехідними. До них також належать інші елементи (відповідних груп) 5, 6 і 7-го періодів, у яких відбувається заповнення d-або f-орбіталей другого або третього зовні електронного шару.
Як тільки 3d-підрівень завершується i на третьому енергетичному рівні розмістяться 18 електронів (на трьох підрівнях: s, p та d)1, починає формуватися 4р-орбіталь до завершення четвертого періоду Криптоном Кr. Аналогічно відбувається заповнення підрівнів електронами в атомах інших великих періодів.
Зауважимо, що атоми Купруму 3d104s1, Аргентуму 4d105s1, Ауруму 4f145d106s1, а також Хрому 3d54s1 і Молібдену 4d65s1 мають у зовнішньому Енергетичному рівні по Одному s-електрону. Це пояснюється особливою стійкістю електронних структур, у яких на d-орбіталях розміщується 5 або 10 електронів (d5 і d10). Унаслідок цього один з двох спарених електроні”, зовнішнього s-шару “провалюється” на d-підрівень попереднього енергетичного рівня. Таке явище називають провалом електрона.
_____________________________________________________
1 Тут є ще одна особливість, пов’язана з енергетичною стабільністю атомів: при переході від Ніколу до Купруму, від Родію до Рутенію, від Іридію до Платини відбувається перехід s-електрона зовнішнього шару на d-орбіталь попереднього.