Адіабатичний процес. Рівняння адіабати
ФІЗИКА
Частина 2 МОЛЕКУЛЯРНА ФІЗИКА І ТЕРМОДИНАМІКА
Розділ 7 ОСНОВИ ТЕРМОДИНАМІКИ
7.5. Адіабатичний процес. Рівняння адіабати
Адіабатичним називають такий процес, який відбувається без теплообміну системи з навколишнім середовищем. Для здійснення адіабатичного процесу треба оточити систему такою оболонкою, яка не пропускає теплоти, але заважає тому, щоб система виконувала роботу або робота виконувалась над системою. Таку оболонку називають адіабатичною. Прикладом оболонки, близької до адіабатичної, може бути оболонка з поганого

Де dU – повний диференціал; δА – неповний диференціал. Нехай моль ідеального газу знаходиться під поршнем. Закріпивши поршень, підвищимо температуру газу на dТ. Оскільки об’єм газу залишається сталим, то кількість теплоти, що потрібна для такого нагрівання, дорівнює СVdТ. А оскільки при цьому не виконується
Якщо початковий стан (T, V) буде таким самим, що й у попередньому досліді, але поршень не закріплений, а може вільно переміщуватися при незмінному зовнішньому тиску р, то газ виконуватиме роботу δА = рdV. Оскільки внутрішня енергія газу залежить тільки від температури, то вона змінюється так само, як і у попередньому випадку.
Отже, при адіабатичному процесі система виконує роботу за рахунок внутрішньої енергії, яка зв’язана з температурою. Зміна внутрішньої енергії при адіабатичному процесі приводить до зміни температури системи. Враховуючи, що ΔА = рΔV і ΔU =СVΔТ, формула (7.10) набере такого вигляду:

При адіабатичному розширенні газу, коли збільшується об’єм (ΔV > 0), з формули (7.11) видно, що температура знижується (ΔT < 0), тобто газ охолоджується. Якщо ж ΔV < 0, то ΔТ > 0, тобто газ нагрівається. До речі, властивість газів охолоджуватись при розширенні їх в адіабатичних умовах покладено в основу принципу дії холодильників. Отже, при адіабатичному процесі температура системи може змінюватись, хоча системі теплота не передається. Звідси випливає, що теплоємність системи при адіабатичному процесі дорівнює нулю. Проте нуль – це стале число, а процес, при якому теплоємність залишається сталою, називають політропним. Тому адіабатичний процес є окремим випадком політропного процесу, а саме таким політропним процесом, при якому теплоємність дорівнює нулю. Рівняння адіабати ідеального газу має такий вигляд:

Де γ = Ср / СV – відношення теплоємності газу при сталому тиску і сталому об’ємі. Рівняння (7.12) називають рівнянням Пуассона. Із співвідношення (7.11) дістанемо вираз для роботи, якщо система адіабатично переходить із одного стану в інший:
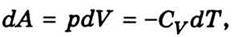
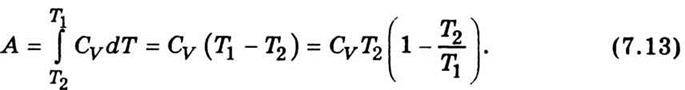
Можна показати, що для адіабатичного процесу

Замінивши в (7.13) відношення температур відношенням об’ємів відповідно до (7.14), дістанемо вираз для роботи при адіабатичному розширенні ідеального газу