Аміни – НІТРОГЕНОВМІСНІ СПОЛУКИ
Хімія підготовка до ЗНО та ДПА
Комплексне видання
ЧАСТИНА І
ЗАГАЛЬНА ХІМІЯ
ОРГАНІЧНА ХІМІЯ
НІТРОГЕНОВМІСНІ СПОЛУКИ
Аміни
Аміни – це клас органічних сполук, які містять у своєму складі аміногрупу (NН2).
Аміногрупа є функціональною для цього класу сполук. Простий представник цього класу – метиламін (СН3NН2). Загальна формула насичених амінів: СnН2n+1 – NH2 або СnН2n+3N.
Номенклатура амінів
Необхідно розрізняти поняття “аммін” і “амін”. Поняття “аммін” відповідає сполукам аміаку, а поняття
Правила побудови назви амінів аналогічні таким самим правилам для спиртів. Назва амінів походить від назви відповідного вуглеводню, при цьому перед назвою вуглеводню ставиться номер атома Карбону, з яким сполучена аміногрупа, і префікс “аміно”. Напииклад, сполука
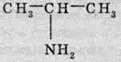
Називатиметься 2-амінопропан.
Залежно від кількості атомів Гідрогену і від кількості замісників, безпосередньо сполучених з атомом Нітрогену, аміни класифікують на первинні, вторинні, третинні та четвертинні:
Тип | Приклад | Кількість атомів Гідрогену | Кількість замісників |
Первинний | CH3NH2 | 2 | 1 |
Вторинний | (СН3)2NH | 1 | 2 |
Третинний | (СН3)3N | 0 | 3 |
Четвертинний | (СН3)4N | 0 | 4 (сольова будова) |
Фізичні властивості
За нормальних умов усі аміни є рідинами або твердими речовинами, окрім метиламіну (СН3NН2, tкип = -6,9 °С). Зі збільшенням кількості атомів Карбону температури фазових переходів збільшуються. Якщо розташувати температури плавлення і кипіння третинних, вторинних і первинних амінів у ряд, то можна простежити таку закономірність: Ттрет < Твтор < Тперв. Це пояснюється утворенням міжмолекулярних водневих зв’язків між атомом Нітрогену й атомами Гідрогену аміногрупи: у третинних амінах такого водню немає, і відповідно міжмолекулярні взаємодії слабші.
Нижчі аміни добре розчиняються у воді, а гомологи з великою кількістю атомів Карбону – погано.
Аміни мають запах амоніаку, а у разі сильного розбавлення запах подібний до запаху риби.
Методи добування
1. Реакція Гофмана (алкілування амоніаку галогеналканами):
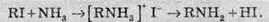
Перебіг реакції продовжується, при цьому відбувається алкілування аміну RNН2 й утворення вторинної похідної R2NН, і так далі, аж до утворення четвертинної амонійної солі.
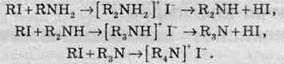
2. Взаємодія амоніаку з оксосполуками (альдегідами та кетонами):
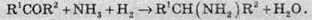
3. Взаємодія амідів карбонових кислот з натрій гіпохлоритом (розщеплення за Гофманом):
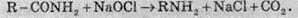
Хімічні властивості
1. Кислотно-основні властивості амінів:
Водні розчини амінів показують лужну реакцію, аналогічно амоніаку, за рахунок гідролізу:
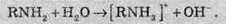
2. Алкілування амінів відбувається аналогічно алкілуванню амоніаку (див. метод добування амінів №1).
3. Взаємодія з нітритною кислотою (НNO2) – якісна реакція на аміни:
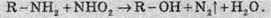
Застосування амінів
Головним чином аміни та їхні похідні використовуються в лакофарбовій промисловості для добування барвників різноманітних відтінків, для добування штучних волокон, а також як високоефективні розчинники.
Анілін
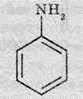
Існують також ароматичні аміни. Формула простого аніліну – амінобензен:
Добування аніліну в промислових масштабах проводять за реакцією, відкритою великим російським ученим Зініним. При цьому нітробензен відновлюється до аніліну під дією відновників:
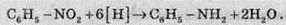
Атомарний водень, який є відновником у цій реакції, добувають безпосередньо в реакційній суміші взаємодією цинку з хлоридною кислотою.
Хімічні властивості аніліну:
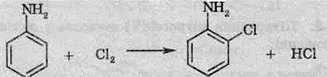
1. Хлорування в орто – або пара-положенні:
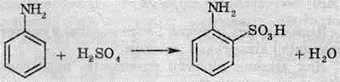
2. Сульфурування в орто – або пара-положенні:
3. Окиснення до нітробензену:
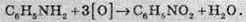
У даний час анілін переважно застосовується для синтезу поліуретанових матеріалів, а також як напівпродукт у виробництві барвників, вибухових речовин і лікарських засобів (сульфаніламідні препарати).
Гетероциклічні сполуки
Гетероциклічні сполуки – це органічні сполуки, які містять циклічні угруповання атомів, серед яких поряд з атомами Карбону присутні й атоми інших елементів (Нітрогену, Оксигену, Сульфуру). Деякі гетероциклічні сполуки виявляють ароматичні властивості, на зразок бензену, що пояснює стійкість таких систем.
Формули деяких гетероциклічних сполук та їхні назви наводяться у таблиці.
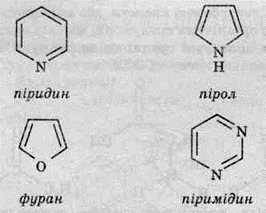
Піридин
Піридин є шестичленною ароматичною гетероциклічною сполукою, що містить один атом Нітрогену. Добувають його як побічний продукт під час переробки кам’яновугільної смоли.
За звичайних умов піридин – це безбарвна рідина, що має специфічний неприємний запах.
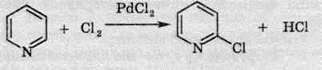
Хімічні властивості піридину
1. Хлорування у присутності каталізатора з утворенням орто-похідної:
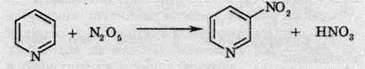
2. Нітрування нітроген(V) оксидом у мета-положенні:
Застосовують піридин і його похідні у синтезі барвників і лікарських речовин.
Для людини піридин токсичний, подразнює нервову систему та шкіру.
Пірол
Пірол є п’ятичленною гетероциклічною сполукою, що містить у циклі один атом Нітрогену. Так само, як і піридин, виявляє ароматичні властивості, проте пірол менш стабільний, ніж піридин. Добувають пірол і його похідні під час сухої перегонки кам’яновугільної смоли.
Пірол у звичайних умовах – безбарвна рідина із запахом, що нагадує запах хлороформу.