Білки – Нітрогеновмісні органічні сполуки
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ III. ОРГАНІЧНА ХІМІЯ
13. Нітрогеновмісні органічні сполуки
13.4. Білки
Білки – це складні високомолекулярні природні сполуки (біополімери), побудовані із залишків α-амінокислот, з’єднаних у певній послідовності пептидними зв’язками.
Білки можна розглядати як поліпептиди, тобто аміди, що утворилися внаслідок взаємодії аміно – і карбоксильних груп амінокислот і які мають молекулярну масу більшу за 10 000 Да. В. усіх видів живих організмів нашої
Розрізняють:
– прості білки (протеїни), макромолекули яких складаються лише із залишків α-амінокислот;
– складні білки (протеїди), під час гідролізу яких, крім амінокислот, вивільняється небілкова частина – простетична група (або продукти її розпаду):
Класи складних білків | Простетична група | Приклади |
Глікопротеїди | Вуглеводи | Імуноглобуліни |
Ліпопротеїди | Ліпіди | Аполіпопротеїни |
Металопротеїди | Іони металів (Cu, Mn, Fe та ін.) | Феритин, трансферин; гемосидерин; металоферменти (монодейодиназа, карбоангідраза) |
Нуклеопротеїди | ДНК або РНК | Хроматин |
Фосфопротеїди | Фосфат | Казеїн |
Хромопротеїди | Магнійпорфіринова | Хлорофіли |
Порфіринова (гем) | Гемопротеїни (гемоглобин, цитохроми), | |
Флавінова | Флавопротеїди |
Будова
Основні відомості про склад білків отримані під час гідролізу, в результаті якого утворюється суміш амінокислот. їхня кількість, залежно від виду білка, може варіювати від 50 до 105. Амінокислотну послідовність білка визначають за допомогою методу секвенування, а тривимірну структуру – за допомогою рентгеноструктурного аналізу.
Виділяють чотири рівні структурної організації білків. Первинна структура білка – це лінійний поліпептидний ланцюг; послідовність амінокислот якого (так звані “консервативні мотиви”) визначає функції білка.
Вторинна структура білка – це локальне упорядкування фрагмента поліпептидного ланцюга, яке буває у вигляді а-спіралі (щільно звитого джгута із 3,6 амінокислотного залишку у витку, стабілізованого водневими зв’язками, що виникає між групами 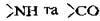 кожної четвертої ланки), β-листа та інших форм.
кожної четвертої ланки), β-листа та інших форм.
Третинна структура білка – це специфічна просторова орієнтація поліпептидного ланцюга (субодиниця, домен), яка визначає біологічну функцію білка і стабілізована завдяки:
– ковалентним зв’язкам (дисульфідним місткам – S-S-);
– сольовим місткам, іонним зв’язкам (зокрема, між карбоксильними – СООН та аміногрупами – NH2);
– водневим зв’язкам;
– утворенню естерних зв’язків 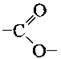 між карбоксильною та гідроксильною групами.
між карбоксильною та гідроксильною групами.
Четвертинна структура білка – це структура, що іноді виникає в результаті взаємодії кількох білкових молекул, субодиниць. Поєднання кількох (інколи десятків) субодиниць, що разом виконують спільну функцію, називають білковим комплексом. Наприклад, молекула білка крові гемоглобіну складається із чотирьох субодиниць, які називають поліпептидними ланцюгами α1, α2, β1 і β2.
Відносні молекулярні маси білків можуть бути дуже великими:
Речовина | Відносна молекулярна маса Мr |
Гормон інсулін | 5700 |
Фермент рибонуклеаза | 15 000 |
Гемоглобін | 68 000 |
Білки деяких вірусів | Близько 50 млн. |
Номенклатура
1. Залежно від групи (-NH2 або – СООН) розрізняють його N – і С-кінець пептидного ланцюга. Оскільки під час синтезу білка на рибосомі приєднання амінокислот відбувається на С-кінці, назву білка (пептиду) утворюють шляхом переліку амінокислотних залишків, що входять до їхнього складу, починаючи з N-кінця. При цьому всі амінокислоти в пептиді, за винятком останньої, що має вільну карбоксильну групу, змінюють у закінченні назви букву “н” на “л” (гліцил-аланін, гліцил-аланіл-цистеїн).
2. Деякі білки мають історичні назви. Наприклад, білок крові складу (C738H1166O208N195S2Fe)4 має назву гемоглобін (від гр. αίμα – кров і лат. globus – куля).
Хімічні властивості білків
1. Амфотерність. Наявність в амінокислотних ланках білків груп – СООН та – NH2 зумовлює взаємодію і з основами, і з кислотами.
2. Денатурація – руйнування вторинної та третинної структур білка під дією температури (> 60 °С), радіації, сильних кислот, лугів, солей важких металічних елементів, сильного струшування та інших чинників. Процес необоротний.
3. Гідроліз – руйнування первинної структури білка з утворенням амінокислот під дією лугів, кислот, ферментів:
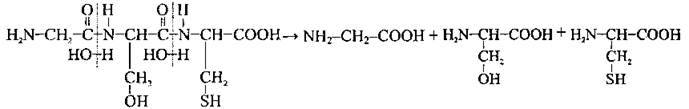
4. Кольорові реакції (здійснюють для аналітичного виявлення білків):
А) біуретова реакція свідчить про наявність пептидних зв’язків: унаслідок дії на білок лугу та кількох крапель розчину купрум(ІІ) сульфату виникає характерне фіолетове забарвлення;
Б) ксантопротеїнова реакція – унаслідок дії нітратної кислоти на білок, що містить бензенові ядра (амінокислоти – тирозин, триптофан, фенілаланін), виникає жовте забарвлення, яке при додаванні лугу змінюється на жовтогаряче.
Значення білків
Разом із жирами, цукрами та нуклеїновими кислотами білки є невід’ємною складовою організмів усіх живих істот.
1. Білки – складова їжі тварин і людини. У травній трубці вони гідролізують до амінокислот, які всмоктуються ворсинками тонкої кишки, звідти кров’ю розносяться до тканин організму і зокрема – до печінки, де відбувається синтез власних білків. Частина їх використовується на енергетичні потреби організму: приблизно 15 % енергії на добу людина отримує за рахунок розщеплення білків.
2. Білки – це основний будівельний матеріал тваринних клітин, вони надають форму клітинам та органелам, беруть участь в утворенні міжклітинної речовини.
3. Білки – це ферменти (біологічні каталізатори), які беруть участь у безлічі біохімічних реакцій (відомо близько 4000 реакцій), значно прискорюючи їх (до 1017 разів).
4. Білки виконують захисні функції (фізичний, хімічний та імунний захист).
5. Білки беруть участь у регуляції складних внутрішньоклітинних процесів, передачі сигналів (гормони, цитокіни) та їх сприйнятті (цитоплазматичні та мембранні білкові рецептори, які сприймають різноманітні сигнали).
6. Білки забезпечують транспорт простих і складних сполук через клітинну мембрану та між тканинами організму.
7. Білки виконують моторні функції, забезпечуючи скорочення м’язів, рух клітин, органел, активний та спрямований внутрішньоклітинний транспорт речовин.