Фізичні властивості спиртів – СПИРТИ Й ФЕНОЛИ
Хімія підготовка до ЗНО та ДПА
Комплексне видання
ЧАСТИНА І
ЗАГАЛЬНА ХІМІЯ
ОРГАНІЧНА ХІМІЯ
СПИРТИ Й ФЕНОЛИ
Фізичні властивості спиртів
У гомологічному ряді спиртів немає газоподібних речовин. Перші члени гомологічного ряду – це рідини, а вищі спирти (від С15) – тверді речовини. У гомологічному ряді нормальних спиртів зі збільшенням молекулярної маси збільшуються температури плавлення й кипіння. Густина спиртів майже не змінюється. Розчинність у воді при цьому погіршується, хоча перші три члени гомологічного
Фізичні властивості спиртів подані в таблиці.
Назва | Формула | Mr | ρ, г/мл | Tпл, °C | Tкип, °C | Розчинність у воді |
Метанол | CH3OH | 32 | 0,79 | -97,5 | 64,5 | Розчиняється |
Етанол | С2Н5ОН | 46 | 0,79 | -114,5 | 78,3 | Розчиняється |
Н-Пропанол | С3Н7ОН | 60 | 0,80 | -126,2 | 97,2 | Розчиняється |
Н-Бутанол | С4Н9ОН | 74 | 0,81 | -89,5 | 117,1 | Погано |
Н-Пентанол | С5Н11ОН | 88 | 0,81 | -78,9 | 138,1 | Дуже погано розчиняється (2% ) |
Н-Гексанол | C6H13OH | 102 | 0,81 | -46,1 | 157,5 | Не розчиняється (0,7%) |
Н-Гептанол | C7H15OH | 117 | 0,81 | -30,6 | 176,4 | Не розчиняється |
Н-Октанол | C8H17OH | 130 | 0,82 | -15 | 195,3 | Не розчиняється |
У ряді насичених одноатомних спиртів, на відміну від насичених і ненасичених вуглеводнів, немає газоподібних речовин, хоча перші члени ряду мало відрізняються від них за молекулярною масою. Це пояснюється утворенням водневого зв’язку між молекулами спиртів.
За рахунок нього молекули спиртів, так само, як і води, асоційовані, між ними існує додаткова сила міжмолекулярної взаємодії.
Сутність водневого зв’язку полягає в тому, що гідроксильний атом Гідрогену внаслідок зсуву електронної густини до Оксигену має частковий позитивний заряд. Атом Оксигену через наявність у нього неподілених електронних пар і зміщеної до нього електронної густини зв’язків O-Н має негативний заряд.
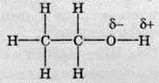
Таким чином встановлюється електростатична взаємодія між атомами Гідрогену й Оксигену різних молекул спирту. Слід також відзначити, що при утворенні водневого зв’язку, крім електростатичного механізму, присутній і донорно-акцепторний механізм. Інакше кажучи, між молекулами встановлюється зв’язок через атом Гідрогену – водневий зв’язок. У формулах його зазвичай позначають трьома крапками.
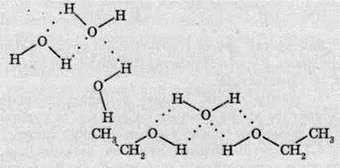
Водневий зв’язок не слід ставити в один ряд зі звичайними видами хімічного зв’язку – ковалентним та іонним. Це особливий вид зв’язку. Його довжина більша, аніж звичайний зв’язок О-Н, а міцність значно менша.
Утворенням водневих зв’язків з молекулами води пояснюється розчинність спиртів. Молекули спиртів складаються ніби з двох частин – розчинної у воді (гідрофільної), яка містить гідроксильну групу, та нерозчинної (гідрофобної), яка складається з вуглеводневого радикала. Якщо вуглеводневий радикал невеликий, то водневі зв’язки гідроксильної групи з молекулами води спроможні втримати молекулу спирту в розчині. Якщо ж молекула спирту має довгий вуглеводневий ланцюг, “який чинить опір” розчиненню, то гідроксильна група вже не в змозі здійснити розчинення речовини.
Щодо загальних фізичних властивостей багатоатомних спиртів слід відзначити, що це в’язкі речовини, добре розчинні у воді й погано розчинні в органічних розчинниках. За рахунок більшого числа можливих водневих зв’язків багатоатомні спирти мають більшу в’язкість, більшу температуру плавлення та кипіння й кращу розчинність порівняно з їхніми одноатомними аналогами.
Етиленгліколь – це безбарвна сиропоподібна рідина, солодкувата на смак, добре розчиняється у воді й спирті, не розчиняється у вуглеводнях та етерах. Температура кипіння +197,9 °С, температура плавлення -12,6 °С, густина 1,12 г/мл. Надзвичайно отруйна!
Гліцерол – безбарвна сиропоподібна, дуже в’язка рідина, не отруйна. Температура плавлення +18,2 °С, температура кипіння +290 ºС, густина 1,26 г/мл. Із водою змішується в будь-яких співвідношеннях, дуже гігроскопічна. За рахунок своєї гігроскопічності використовується для пом’якшення шкіри в шкіряній промисловості та фармації.