Гідратація іонів – РОЗЧИНИ
ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Частина І. ЗАГАЛЬНА ХІМІЯ
Розділ 5. РОЗЧИНИ. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ
§ 5.7. Гідратація іонів
Відомий російський хімік І. О. Каблуков довів, що електролітичну дисоціацію не можна пояснити без хімічної теорії розчинів Д. І. Менделєєва. Як відомо, Д. І. Менделєєв експериментально обгрунтував утворення хімічних сполук під час взаємодії розчиненої речовини з розчинником. Дійсно, під час розчинення відбувається хімічна взаємодія розчиненої речовини з водою, яка
Гідратовані іони містять як стале, так і змінне число молекул води. Гідрат сталого складу утворює іон гідрогену Н, що утримує одну молекулу води, – це гідратований протон Н (Н2О). У науковій літературі його зображують формулою
Слід пам’ятати, що в розчинах немає іона Н+, а є іон Н3О+, який іноді для спрощення умовно позначають символом Н+. Говорячи про іон гідрогену в розчинах, завжди мають на увазі іон гідроксонію.
1 Сольватація – хімічний зв’язок іонів з молекулами неводного розчинника.
Механізм виникнення міцного ковалентного зв’язку в іоні Н3О донорно-акцепторний:
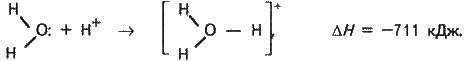
Молекула води – донор, протон – акцептор.
Однак думки хіміків розділились. Одні уважають, що в розчині існують тільки іони гідроксонію Н3О, а інші – що крім іона Н3О є також іони Н9О4 (які можна уявити як Н ∙ 4Н2O або Н3О -3Н2O) і Н7О3+ (Н+∙ 3Н2O або Н3О+∙ 2Н2О). Жодне з цих припущень експериментально не підтверджене. Більшість інших іонів також утворюють гідрати змінного складу. Тому краще зображувати іон гідрогену як Н (водн.), що означає гідратований іон гідрогену. Аналогічно слід поступати і при написанні інших гідратованих іонів. Наприклад:
НСl (газ) ⇆ Н+ (водн.) + Сl – (водн.);
СН3СООН (водн.) ⇆ Н+ (водн.) + СН3СОО – (водн.);
HSO4 (водн.) ⇆Н+ (водн.) + SO42- (водн.).
Проте, звичайно, для спрощення запису вказівки в дужках випускають.