Іонні рівняння
Тема 1
РОЗЧИНИ
Урок 17
Тема уроку. Іонні рівняння
Цілі уроку: закріпити вміння складати іонні рівняння реакцій; розвивати навички складання рівнянь хімічних реакцій на прикладі реакцій у розчинах електролітів; удосконалювати навички складання хімічних формул та іонних рівнянь.
Тип уроку: творчого застосування знань, умінь і навичок.
Форми роботи: фронтальна, групова, самостійна робота.
Обладнання: таблиця розчинності, картки із завданнями.
ХІД УРОКУ
I. Організація класу
II. Аналіз практичної роботи, перевірка
III. Виконання тренувальних вправ
Завдання 1. Запишіть у іонній формі рівняння реакцій у розчинах електролітів, виберіть ті, у яких виділяється газоподібна речовина.

Завдання 2. Запишіть у іонній формі рівняння за схемою, виберіть рівняння з однаковою іонною формою.
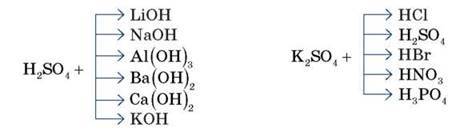
Завдання 3 (самостійно, з наступним обговоренням біля дошки, кожен пропонує свій варіант). Підберіть і запишіть чотири-п’ять рівнянь для здійснення іонної реакції за схемою:
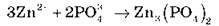
Завдання 4. Складіть іонні рівняння можливих реакцій
Na2CО3 | CuSО4 | Ba(NО3)2 | PbCl2 | Na3PО4 |
I | Na2SО4 | |||
II | AgNО3 | |||
III | Al2(SО4)3 | |||
IV | BaCl2 | |||
V | Zn(NО3)2 |
Групове завдання
1) Обчисліть масу осаду, одержаного в результаті змішування розчину барій нітрату масою 47 г з масовою часткою 24 % з надлишком сульфатної кислоти.
2) Обчисліть об’єм вуглекислого газу (н. у.), що виділиться в результаті дії на кальцій карбонат 200 г розчину нітратної кислоти з масовою часткою 17 %.
3) Обчисліть масу 15%-го розчину хлоридної кислоти, який необхідно додати до 120 г 25%-го розчину кальцій гідроксиду для повної нейтралізації.
4) Обчисліть кількість речовини іонів SO42- у розчині алюміній сульфату, що містить 70 г цієї солі.
5) Обчисліть кількість речовини катіонів Na + у 180 г розчину натрій гідроксиду з масовою часткою 42 %.
IV. Самостійна робота
Завдання 1
Складіть іонні рівняння взаємодії:
Варіант І
А) H3PO4 + KOH 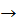
Б) ZnCl2 + NaOH 
Варіант ІІ
А) H2SO4 + NaOH 
Б) K2SO3 + HCl 
Завдання 2
Складіть молекулярне рівняння, що відповідає скороченому іонному:
Варіант І
2H+ + S2-  H2S
H2S
Варіант ІІ
Zn2+ + 2OH –  Zn(OH)2
Zn(OH)2
Завдання 3
Обчисліть масу осаду, одержаного в результаті змішування розчинів:
– варіант І: Ba(NO3)2 масою 120 г і масовою часткою 10 % з натрій сульфатом;
– варіант ІІ: AgNO3 масою 170 г і масовою часткою 5 % з натрій хлоридом.
V. Підбиття підсумків уроку
Учитель підбиває підсумки уроку, оцінює роботу учнів, проводить обговорення результатів самостійної роботи.
VI. Домашнє завдання
Повторити властивості розчинів, теорію електролітичної дисоціації, іонні рівняння.