Кальцій. Кальцій оксид і гідроксид. Солі Кальцію. Поняття про твердість води. Використання найважливіших сполук Кальцію
ІІ семестр
Тема 2. МЕТАЛІЧНІ ЕЛЕМЕНТИ ТА ЇХНІ СПОЛУКИ (13 годин)
УРОК 29
Тема уроку. Кальцій. Кальцій оксид і гідроксид. Солі Кальцію. Поняття про твердість води. Використання найважливіших сполук Кальцію
Цілі уроку: розширити знання учнів про метали на прикладі лужноземельних металів; вивчити властивості лужноземельних металів, їхніх сполук, способи одержання й застосування на прикладі Кальцію; продовжити формування вмінь і навичок складання рівнянь хімічних реакцій на прикладі властивостей Кальцію; показати зв’язок між
Тип уроку: комбінований урок засвоєння знань, умінь і навичок і творчого застосування їх на практиці.
Форми роботи: семінар, фронтальна робота.
Обладнання: періодична таблиця хімічних елементів, таблиця розчинності, колекція “Вапняки”.
Демонстрація 2. Взаємодія кальцій оксиду з водою та дослідження утвореного розчину фенолфталеїном.
Демонстрація 1. Горіння магнію.
ХІД УРОКУ
I. Організація класу
II. Перевірка домашнього завдання, мотивація
1. Порівняйте будову атомів К та Са.
2. Порівняйте фізичні властивості К та Са.
3. Як називаються елементи головної підгрупи ІІ групи? (Лужноземельні)
4. Назвіть найактивніший лужноземельний метал. Обгрунтуйте свій вибір.
5. Припустіть, який лужноземельний метал є найменш активним. (Пояснюємо, що Ве є амфотерним елементом.) розглянемо на прикладі Кальцію властивості лужноземельних металів, їх будову, способи одержання й галузі застосування.
ІІІ. Вивчення нового матеріалу
Семінар за планом
1. Положення Кальцію в періодичній системі, будова його атома
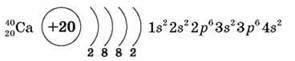
2. Фізичні властивості
Порівнюємо властивості за таблицею лужноземельних металів.
Mg | Ca | Sr | Ba | Ra | |
?, г/см3 | 1,74 | 1,55 | 2,63 | 3,76 | 6 |
Tпл, °С | 650 | 842 | 770 | 969 | 727 |
Колір | Сріблясто-білий | Білий | |||
Примітки | Вкривається оксидною плівкою | Твердий, на повітрі окислюється |
3. Поширення в природі (~3 % маси)
Розглядаємо колекцію вапняків.
– Доломіт MgCО3 – CaCО3.
– Магнезит MgCО3.
– Вапняк, крейда, мармур CaCО3.
– Каїніт KCl – MgSО4 – 3H2О.
– Алебастр, палений гіпс (СaSО4)2 – H2О.
– Карналіт KCl – MgCl2 – 6H2О.
– Гіпс CaSО4 – 2H2О.
– Фосфорит Ca3 (PО4)2.
4. Способи одержання
Одержують електролізом розплаву CaCl2:
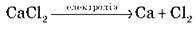
5. Хімічні властивості Кальцію
1) Взаємодія з неметалами (учні по ланцюжку записують на дошці рівняння реакцій):
Ca + Cl2 =
Ca + H2 =
Ca + О2 =
Ca + S =
Ca + N2 =
2) Взаємодія з водою.
Демонстрація 2. Взаємодія кальцію з водою З холодною реагує повільно, з гарячою – швидко:
Ca + H2О = Ca(ОH)2 + H2
Дослідження розчину фенолфталеїном підтверджують лужне середовище розчину.
3) Взаємодія з кислотами:
Ca + 2HCl = CaCl2 + H2
Записати ОВР:
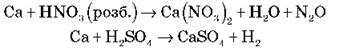
4) Відновлює оксиди металів:
3Ca + Al2O3 = 3CaO + 2Al
6. Кальцій оксид
Кальцій оксид CaO, негашене вапно – біла, вогнестійка речовина, tпл = 2 600 °С.
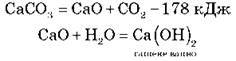
7. Кальцій гідроксид
Кальцій гідроксид Ca(OH)2, рихлий порошок, малорозчинний у воді, розчин має лужну реакцію. Вапняна вода – прозорий розчин Ca(ОH)2, використовується для виявлення СО2.
8. Солі Кальцію
Найбільше практичне значення мають:
– Крейда CaCО3.
– Гіпс 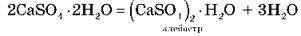
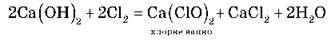
Застосовується для дезінфекції:
Ca(ClO) + H2О + СО2 = CaCО3 + 2HClO
2HClO = 2HCl + O2
9. Твердість води
1) Тимчасова (карбонатна) твердість зумовлена наявністю гідрогенкарбонатів Кальцію й Магнію: Ca(HCO3)2, Mg(HCO3)2. Усувається шляхом кип’ятіння або з допомогою спеціальних добавок, що містять соду:
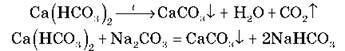
2) Постійна твердість зумовлена наявністю інших розчинних солей Кальцію й Магнію, наприклад: CaSO4, MgSO4.
Усувається з допомогою розчинних карбонатів або фосфатів:
3CaSO4 + 2Na3PO4 = 3Na2SO4 + Ca3(PO4)2
10. Використання сполук Кальцію
IV. Закріплення вивченого матеріалу
Узагальнення вчителя, заповнення опорної схеми.
V. Тренувальні вправи
1. Складіть рівняння, що описують усунення твердості води, спричиненої магній гідрогенкарбонатом і магній сульфатом.
2. Легкі пористі бетони одержують шляхом взаємодії алюмінію з кальцій гідроксидом:
Ca(OH)2 + 2Al + 2H2O = Ca (H2AlO2) + H2
Водень спінює масу. Такий бетон використовується як тепло – та звукоізоляційний матеріал. Обчисліть маси кальцій гідроксиду й алюмінію, необхідні для одержання 560 л водню (н. у.).
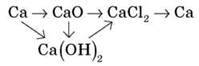
3. Складіть рівняння реакцій за схемою:
VI. Підбиття підсумків уроку, оцінювання роботи учнів
VII. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання.
Випереджальні завдання
1. Положення Алюмінію в періодичній системі, будова атома.
2. Фізичні властивості алюмінію.
3. Природні сполуки Алюмінію.
4. Способи одержання алюмінію.
5. Хімічні властивості Алюмінію:
А) взаємодія з простими речовинами;
Б) взаємодія з кислотами й лугами.
6. Алюміній оксид, його амфотерні властивості.
7. Алюміній гідроксид, його амфотерні властивості.
8. Застосування Алюмінію, його сплавів та сполук.