Класифікація хімічних елементів і речовин. Властивості основних класів неорганічних сполук
РОЗДІЛ 1 ПОВТОРЕННЯ ТА ПОГЛИБЛЕННЯ ТЕОРЕТИЧНИХ ПИТАНЬ КУРСУ ХІМІЇ ОСНОВНОЇ ШКОЛИ
§ 1. Класифікація хімічних елементів і речовин. Властивості основних класів неорганічних сполук
Усвідомлення змісту цього параграфа дає змогу: класифікувати хімічні елементи та їх речовини; визначати властивості основних класів неорганічних сполук; називати хімічні елементи та їх сполуки; наводити приклади s-,p-, d-елементів;
Складати рівняння хімічних реакцій, які відображають хімічні властивості оксидів, основ, кислот,
Хімічні елементи – це складові простих і складних речовин.
Хімічний елемент – це сукупність атомів з однаковим зарядом ядра.
Кожний хімічний елемент характеризується ступенями окиснення, які можуть виявляти його атоми у сполуках. Під час хімічних реакцій елементи зберігаються, оскільки при цьому відбувається лише розподіл електронів зовнішніх електронних оболонок атомів, а ядра залишаються незмінними.
Одну з перших спроб класифікації хімічних елементів здійснив шведський хімік Я. Берцеліус у 1804 р. Він класифікував усі відомі на той час 32 елементи на металічні та неметалічні (за відмінністю
Нині відомо 114 хімічних елементів, з них 22 – неметалічні елементи, наприклад H, B, C, Si, N, P, As, O, S, Se, Te, галогени та інертні гази; 92 – металічні елементи.
За будовою електронних оболонок атомів хімічні елементи поділяють на s-, p-, d-, f-елементи. Наприклад, H, He, Na, Ca – s-елементи, C, N, P, O – p-елементи, Cr, Mn, Fe, Zn – d-елементи.
За походженням елементи класифікують на природні та штучні, які добуті внаслідок перебігу ядерних реакцій. Так, елементи з протонним числом > 94 – штучні.
За поширенням у природі елементи поділяють на поширені та розсіяні, або рідкісні.
Взаємозв’язок усіх хімічних елементів відображає періодична система хімічних елементів Д. І. Менделєєва.
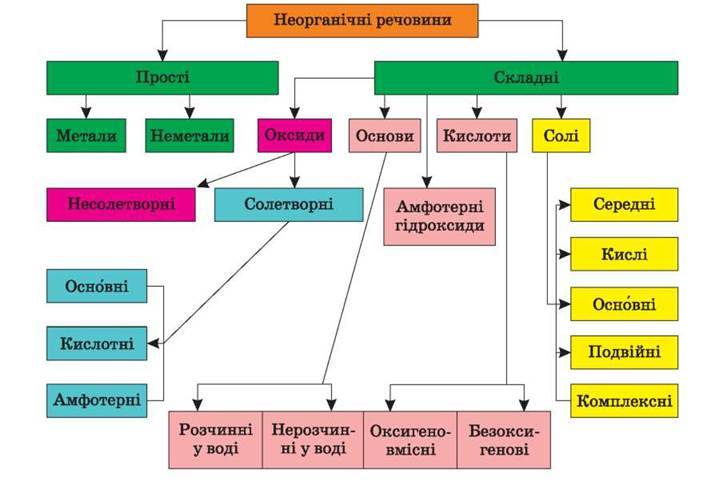
У природі хімічні елементи існують у формі простих і складних речовин. Складні речовини поділяються на органічні та неорганічні. Класифікацію неорганічних речовин наведено на схемі 1.
– Наведіть означення кожного класу (підкласу) основних неорганічних сполук, користуючись схемою 1.
– Запишіть формулу й зазначте назву представника кожної класифікаційної одиниці.
С х е м а 1
Класифікація неорганічних речовин
Для прикладу розглянемо солі.
Солі – це складні речовини, утворені катіонами металічних елементів та аніонами кислотних залишків.
Таке означення стосується середніх, або нормальних, солей, що їх можна розглядати як продукти повного заміщення йонів Гідрогену в кислотах йонами металічних елементів або гідроксильних груп в основах кислотними залишками, наприклад Na2SO4, К3РО4.
Кислі солі – продукти неповного заміщення йонів Гідрогену в моле
Кулі кислоти на йони металічного елемента, наприклад NaHCO3 – натрій гідрогенкарбонат, КН2РО4 – калій дигідрогенортофосфат.
Оснввні солі – продукти неповного заміщення гідроксогруп в основі на йони кислотного залишку, наприклад Cu(OH)Cl – купрум гідроксо – хлорид, Al(OH)SO4 – алюміній гідроксосульфат.
Подвійні солі – продукти заміщення йонів Гідрогену в молекулі кислоти йонами двох різних металічних елементів, наприклад KAl(SO4)2 – калій-алюміній сульфат (алюмокалієвий галун).
Комплексні солі – це солі, до складу яких входять комплексні йони. Вони містять хоча б один хімічний зв’язок, утворений за донорно-акцепторним механізмом, наприклад Na2[Zn(OH)4] – натрій тетрагідроксоцинкат, K3[Fe(CN)6] – калій гексаціаноферат(ІІІ) (червона кров’яна сіль).
Поділ складних речовин на класи грунтується на подібності їх хімічних властивостей. У табл. 1 наведено властивості солетворних оксидів.
– Розгляньте табл. 1, виразіть її зміст за допомоги формул і відповідних рівнянь хімічних реакцій.
Т а б л и ц я 1
Властивості солетворних оксидів
Характеристики | Оксиди | ||
Основні | Кислотні | Амфотерні | |
Агрегатний стан | Твердий | Твердий, рідкий, газуватий | Твердий |
Тип хімічного зв’язку | Йонний | Ковалентний Полярний | Йонно- Ковалентний |
Характер гідроксиду | Основа | Кислота | Виявляє властивості кислоти й основи |
Хімічні властивості | |||
Взаємодія з: | |||
Лугами | – | Утворюють солі | Утворюють солі |
Кислотами | Утворюють солі | – | Утворюють солі |
Оксидами основними | – | Утворюють солі | Утворюють солі |
Оксидами Кислотними | Утворюють солі | – | Утворюють солі |
– Пригадайте, які властивості характерні для основ.
Основи є твердими речовинами. За розчинністю у воді вони поділяються на розчинні (луги) і нерозчинні. Лугами є гідроксиди лужних і лужноземельних елементів. Луги – йонні сполуки, хімічний зв’язок в інших основах має йонно-ковалентний характер. Хімічні властивості основ наведено в таблиці 2.
– Наведіть приклади основ, розчинних у воді та нерозчинних. Запишіть їх формули і назви.
Т а б л и ц я 2
Хімічні властивості основ
Властивості | Основи | |
Луги | Нерозчинні | |
Дія на індикатори | Змінюють забарвлення індикаторів | Не діють на індикатори |
Дисоціація на йони у водних розчинах | KOH = K+ + OH – Ba(OH)2 = Ba2+ + 2OH- | Дуже слабко дисоціюють на йони |
Взаємодія з: | ||
Кислотами | NaOH + HCl = NaCl + H2O | Mg(OH)2 + 2HNO3 = = Mg(NO3), + 2H, O |
Амфотерними Гідроксидами | NaOH +Al(OH)3 = NaAlO2 + 2H2O NaOH +Al(OH)3= Na[Al(OH)4] – у водних розчинах | – |
Кислотними Оксидами | Ca(OH)2 + CO2 = CaCO3| + H2O | – |
Амфотерними Оксидами | 2NaOH + Cr2O3 = 2NaCrO2 + H2O | – |
Середніми Солями | CuCl2 + 2NaOH = Cu(OH)2 j + + 2NaCl | – |
Кислими солями | NaOH + NaHCO3 = Na, CO3 + H2O | – |
Розклад під час нагрівання | NaOH, KOH – не розкладаються Ca(OH)2, Sr(OH)2 – розкладаються Ba(0H)2 = BaO + H2O | Mg(OH)2 = MgO + H2O |
– Пригадаємо властивості кислот. Кислоти можуть бути твердими (H3PO4, HВO3) й рідкими (H2SO4, HNO3). Водні розчини газуватих водневих сполук деяких неметалічних елементів (HF, HCI, HBr, HI, H2S) також є кислотами. Більшість кислот добре розчиняється у воді. У молекулах кислот атоми Гідрогену зв’язані з кислотними залишками ковалентним полярним зв’язком.
Щодо хімічних властивостей, то:
1. Кислоти у водних розчинах дисоціюють на йони – сильні кислоти повністю, слабкі – мало:
HNO3 = H+ + NO-3
За наявності у розчині йонів H+ кислоти змінюють забарвлення індикаторів.
2. Кислоти реагують з основами та амфотерними гідроксидами:
NaOH + HNO3 = NaNO3 + H2O
ОН – + Н+ = Н2О
Fe(OH)3 + 3HCl = FeCI3 + 3H2O
Fe(OH)3 + 3H+ = Fe3+ + 3H2 О
3. Кислоти реагують з основними та амфотерними оксидами:
CaO + 2HCI = CaCl2 + H2O
ZnO + 2HNO3 = Zn(N03)2 + H2O
4. Кислоти взаємодіють з металами:
Mg + H2SO4 = MgSO4 + H2
– Користуючись витискувальним рядом металів, пригадайте, які метали витісняють водень, а які – не витісняють його з кислот.
5. Оксигеновмісні кислоти під час нагрівання розкладаються:
H2SO4 = SO3 + H2O
Амфотерні гідроксиди Zn(OH)2, Pb(OH)2, Al(OH)3 усі є твердими речовинами, нерозчинними у воді. Тип зв’язку між атомом металічного елемента та гідроксогрупою – ковалентний. Під дією кислот амфотерні гідроксиди виявляють основні властивості:
Zn(OH)2 + 2HNO3 = Zn(NO3)2 + 2H2O,
А під дією сильних основ (лугів) – кислотні:
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Солі – це тверді кристалічні речовини йонної будови, мають різний колір і різну розчинність у воді.
1. Реагують з лугами:
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl
2. Реагують з кислотами:
CuCl2 + H2SO4 = CuSO4 + 2HCl
Крист. конц.
3. Взаємодіють між собою:
BaCl2 + Na2CO3 = BaCO3 + 2NaCl
4. Взаємодіють з металами (пригадайте, з якими саме):
Fe + CuSO4 = FeSO4 + Cu
5. Розкладаються під час нагрівання:
CaCO3 = CaO + CO2
Коротко про головне
Хімічні елементи – це сукупності атомів з однаковими зарядами їх ядер. Нині відомо понад 114 хімічних елементів. Усі вони знайшли своє місце у періодичній системі хімічних елементів Д. І. Менделєєва.
Хімічні елементи класифікують за відмінністю властивостей простих речовин, які їм відповідають, за будовою електронних оболонок їх атомів та походженням і поширенням у природі.
Формою існування хімічних елементів є речовини. Складні неорганічні речовини поділяють на класи за подібністю їх будови, складу та хімічних властивостей.
