Константа дисоціації – Електролітична дисоціація
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ
6. Суміші речовин. Розчини
6.6. Електролітична дисоціація
6.6.4. Константа дисоціації
Як уже згадувалось, дисоціація – процес оборотний: паралельно з розщепленням молекул на йони відбуваються процеси сполучення йонів у молекули – асоціація. Під час дисоціації слабких електролітів, наприклад нітритної кислоти, у певний момент встановлюється динамічна рівновага:
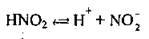
Константу рівноваги для слабких
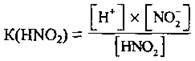
Або в загальному вигляді: 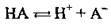 (де А – – аніон).
(де А – – аніон).
Константа дисоціації залежить від природи електроліту, природи розчинника і температури.
Що більше значення константи дисоціації, то легше електроліт розпадається на йони, то більше йонів у його розчині, то сильніший електроліт.
Константою дисоціації визначається сила кислоти: що вище К, що легше кислота дисоціює, то вона сильніша. Так, наприклад: K(HF) = 7,0
Константа дисоціації більш універсально та об’єктивно характеризує силу електроліту, ніж ступінь дисоціації, який залежить від концентрації електроліту.
Якщо кислота багатоосновна, то її дисоціація відбувається ступінчасто, а тому характеризується кільком значеннями константи дисоціації. Наприклад, при дисоціації ортофосфатної кислоти Н3РО4 на першій стад відділяється один протон:
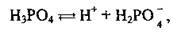
Встановлюється перша рівновага:
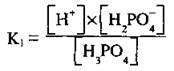
На другій стадії відділяється ще один протон:
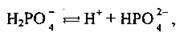
Встановлюється друга рівновага:
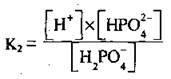
На третій стадії відділяється ще один протон:
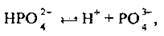
Встановлюється третя рівновага:
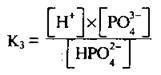
На першій стадії дисоціація відбувається найлегше, відрив йона Н+ від аніона (Н2РО4- і тим більше НРО42- на кожній наступній стадії є все більш утрудненим (збільшується енергія, яка необхідна для його відриву). Тому в розчині поряд з недисоційованими молекулами Н3РО4 є доволі багато йонів Н2РО4-, мало йонів НРО42- і дуже мало РО43-. Отже,
К1 > К2 > К3
Для сульфатної кислоти К1 = 1000, а К2 = 10-2. Отже, за першим ступенем дисоціації сульфатна кислота – сильна, за другим – слабка3.
Загальна константа дисоціації:
К = К1 х К2 х К3
Аналогічні процеси і співвідношення констант мають місце і під час дисоціації багатокислотних основ.
_____________________________________________________________
1 Інколи їх відносять до слабких.
2 У випадку із солями константу дисоціації іноді називають константою іонізації.
3 Іноді виділяють кислоти середньої сили з константою дисоціації в межах від 10-4 до 10-2.
Суперкислота – речовина або суміш речовин, кислотність якої є більшою за кислотність 100 %-ої сульфатної кислоти. Наприклад, прості суперкислоти – флуорсульфонова FSО3H і трифлуорметансульфонова CF3SО3H кислоти приблизно в тисячу разів сильніші за сульфатну; карборанова кислота Н(СНВ11Сl11) – найсильніша із суперкислот яку можна зберігати у скляному посуді; приблизно в мільйон разів сильніша за сульфатну.
На сьогодні найбільш сильною суперкислотною системою є комплексна сполука гідроген гексафлуорантимонат H (або фторсурм’яна кислота). Вона у 2 · 1019 разів сильніша за 100 %-ну сульфатну кислоту.
Термін “суперкислота” уведено Дж. Конантом 1927 р. для класифікації кислот, сильніших за звичайні мінеральні кислоти. За дослідження суперкислот Д. Ола був нагороджений Нобелівською премією 1994 р.