Механізми електролітичної дисоціації у водному розчині – Електролітична дисоціація
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ
6. Суміші речовин. Розчини
6.6. Електролітична дисоціація
Залежно від своєї природи речовини по-різному розчиняються у воді. Речовини з атомними кристалічними гратками є надзвичайно стійкими і у воді не розчиняються. Багато речовин з молекулярними кристалічними гратками (з неполярним ковалентним зв’язком) розчиняється у воді, розпадаючись до молекул – електронейтральних частинок. їхні розчини не містять носіїв електричного
Значна частина речовин з молекулярними кристалічними гратками, утворених за допомогою полярного ковалентного зв’язку (мають полярні молекули), багато речовин з йонними кристалічними гратками під час розчинення в полярному розчиннику (наприклад, воді) розпадається на йони – відбувається електролітична дисоціація2. Дисоціації в розчинах піддаються речовини з іонним і ковалентним полярним зв’язком, у розплавах – лише з іонним.
__________________________________________________________
1
2 Класичну теорію електролітичної дисоціації створили 1887 р. С. Арреніус (1859-1927) і В. Ф. Оствальд (1853- 1932). Послідовник Д. І. Менделєєва І. О. Каблуков (1857-1942) доповнив теорію ідеєю гідратації йонів.
6.6.1. Механізми електролітичної дисоціації у водному розчині
Під час розчинення речовини у воді відбувається гідратація – оточення полярних молекул або йонів диполями води.
1. Дисоціація полярних молекул (диполь-дипольний механізм).
Дипольні (полярні) молекули електроліту при розчиненні його у воді взаємодіють з полярними молекулами води. Так, наприклад, у молекулі хлороводню НСl під впливом цієї взаємодії змінюється характер зв’язку: зв’язок Н-Cl стає ще більш полярним і поступово перетворюється на йонний. Йони Н+ і Сl-, що переходять у розчин, зв’язуються з молекулами води, утворюючи гідратовані йони:
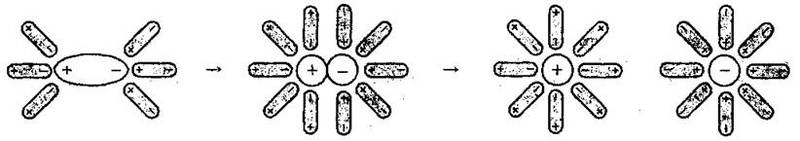
2. Дисоціація електролітів з йонним типом зв’язку (іон-дипольний механізм).
Найлегше дисоціюють у воді речовини з йонним зв’язком. Полярні молекули води орієнтуються відповідним чином навколо частинок розчиненого у воді електроліту, що приводить до ослаблення зв’язків між позитивно і негативно зарядженими йонами, які містяться на поверхні кристала. Як результат, зв’язки розриваються утворюються гідратовані йони, тобто йони, хімічно зв’язані з молекулами води:
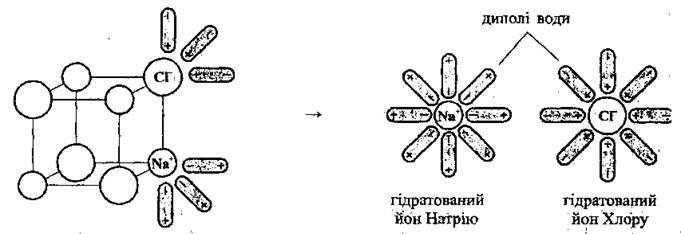
Процес розпаду, але без участі молекул води, відбувається і під час розплавлення цих речовин (коли кінетична енергія йонів перевищує енергію взаємодії йонів у кристалі). Такі речовини називають електролітами.
Електроліти – це речовини, які в розчиненому або розплавленому стані здатні проводити електричний струм. До них належать розчини (розплави) кислот, лугів і солей. Це провідники другого типу, тобто самі о собі за звичайних умов струму вони не проводять. їхня електропровідність зумовлена лише наявністю йонів, з яких вони частково або повністю складаються у розчинах і розплавах.
Електроліти | Неелектроліти | |
Хімічні зв’язки | Йонні або ковалентні сильно полярні | Ковалентні, мало полярні, або ковалентні неполярні |
Приклади сполук | Солі (КСl, Na2SO4, K2PO4), кислоти (НСl, H2SO4, HNO3), луги (KОН, Ва(ОН)2) | Органічні речовини (вуглеводні, вуглеводи, спирти, альдегіди, естери) |
