Мило, його мийна дія. Відомості про синтетичні мийні засоби, їхнє значення. Захист природи від забруднення синтетичними мийними засобами
II Семестр
Тема 4. ОКСИГЕНОВМІСНІ ОРГАНІЧНІ СПОЛУКИ
Урок 43
Тема уроку. Мило, його мийна дія. Відомості про синтетичні мийні засоби, їхнє значення. Захист природи від забруднення синтетичними мийними засобами
Цілі уроку: розвивати знання учнів про карбонові кислоти та їхні солі; формувати знання про мила як солі вищих карбонових кислот; ознайомити учнів зі складом молекул мила, синтетичних мийних засобів; пояснити принцип їх мийної дії; показати екологічний аспект раціонального використання мийних засобів, їхню роль у забрудненні
Тип уроку: комбінований урок засвоєння знань, умінь і навичок і творчого застосування їх на практиці.
Форми роботи: розповідь учителя, міні-семінар.
Лабораторний дослід 10. Порівняння властивостей мила й синтетичних мийних засобів.
Обладнання: презентації учнів.
ХІД УРОКУ
I. Організація класу
II. Перевірка домашнього завдання.
Актуалізація опорних знань
1. Перевірка домашнього завдання
2. Експрес-опитування
1) Жирами називаються органічні речовини:
А) естери вищих карбонових кислот і етанолу;
Б) естери
В) естери низькомолекулярних карбонових кислот і гліцерину.
2) Жири за агрегатним станом поділяються на… і…
3) Тверді жири містять у своєму складі. вищі кислоти та є жирами… походження.
4) Олії містять у своєму складі. вищі кислоти та є жирами… походження.
5) У природі існують жири:
А) лише рослинного походження;
Б) лише тваринного походження;
В) рослинного і тваринного походження.
6) Жири щодо води:
А) розчинні;
Б) погано розчинні;
В) гідрофобні.
7) Жири як естери вступають у реакцію:
А) дегідратації;
Б) гідрування;
В) гідролізу.
8) Жири застосовуються:
А) як харчовий продукт;
Б) у медицині;
В) у текстильній промисловості.
9) Мила – це:
А) натрієві солі оцтової кислоти;
Б) натрієві солі вищих карбонових кислот;
В) натрієві або калієві солі вищих карбонових кислот.
10) Мийна дія мила пояснюється тим, що воно:
А) розщеплює частинки бруду;
Б) створює лужне середовище в розчині;
В) служить “містком” між частинками бруду й води.
11) Мийна дія мила у твердій воді зменшується, тому що:
А) молекули мила розкладаються;
Б) солі вищих кислот і Кальцію випадають в осад;
В) тверда вода нейтралізує молекули мила.
III. Вивчення нового матеріалу
1. Розповідь учителя
Сучасні теоретичні положення про механізм мийної дії, що набули наразі загального визнання, були розроблені академіком П. О. Ребіндером та його співробітниками. В основі зовні простого й легко виконуваного процесу відмивання забруднень перебуває цілий комплекс прихованих, але пов’язаних між собою в єдину систему, фізико-хімічних явищ. Унаслідок розчинення мила у воді поверхневий натяг останньої різко знижується. Завдяки цьому значною мірою підвищується змочувальна здатність мильного розчину, що легко розтікається гідрофобними поверхнями й усмоктується в тканину, проникаючи не лише між нитками, але й у найтонші капіляри – пори волокон. Це прискорює набухання тканини й ослабляє зв’язки частинок бруду з поверхнею, яку очищують. Водночас мильний розчин проникає в найтонші щілини гідрофобних агрегатів бруду й подрібнює їх до частинок колоїдних розмірів. Адсорбуючись на гідрофобній частинці бруду, молекули й міцели мила своїми гідрофобними кінцями орієнтуються до поверхні частинки забруднювача, а гідрофільними – до води. У результаті навколо частинки бруду утворюється гідрофілізуюча мильна плівка, що після набухання продовжує збільшувати відстань між частинкою забруднювача та поверхнею, на якій він знаходиться. За цих умов достатньо незначного механічного впливу (перемішування, тертя), щоб міжмолекулярні зв’язки між частинками бруду й поверхнею порушилися і ці частинки відірвалися, перейшовши в мильний розчин і піну. Механізм відриву частинок бруду грунтується на явищі емульгування, якщо частинки бруду рідкі (олії, жиропотові виділення), або суспендування – пептизації, якщо частинки бруду тверді (пил, сажа). Великі частинки забруднювачів, що лишилися не подрібненими, також огортаються мильною плівкою, емульгуються й суспендуються, тобто, як і колоїдні частинки, переводяться в мийний розчин, перебуваючи в ньому у зваженому стані. У разі зміни мийного розчину всі частинки бруду видаляються.
Отже, процес миття складається з трьох стадій: 1) відриву частинок бруду від поверхні, яку очищують; 2) переведенні окремих частинок бруду в мийний розчин; 3) утриманні частинок, що плавають у мийному розчині, до зміни останнього.
2. Повідомлення учнів
Історія мила
Мило було відоме людині ще до нової ери. Учені не мають інформації про те, коли почали виготовляти мило в арабських країнах і Китаї. Найбільш ранню письмову згадку про мило в європейських країнах знаходимо в римського письменника й ученого Плінія Старшого (23-79 рр. н. е.). У трактаті “Природнича історія” (у 37 томах), що, по суті, був енциклопедією природничо-наукових знань античності, Пліній писав про способи приготування мила шляхом омилення жирів. Мало того, він писав про тверде і м’яке мила, які одержують, використовуючи соду й поташ відповідно. Раніше для прання одягу використовували луг, який одержували шляхом обробки золи водою. Швидше за все, це було до тих часів, як стало відомо, що зола від спалювання палива рослинного походження містить поташ.
Розвитку миловаріння сприяла наявність сировинних джерел. Наприклад, марсельська миловарна промисловість, відома з епохи раннього середньовіччя, мала у своєму розпорядженні маслинову олію й соду. Маслинову олію одержують шляхом простого холодного пресування плодів маслинових дерев. Олію, одержувану після перших двох пресувань, використовували для вживання в їжу, а після третього – для переробки на мило. Марсельське мило було важливим товаром торгівлі вже в IX ст. Воно поступилося своїм місцем у міжнародній торгівлі венеціанському милу лише з кінця середніх століть (XIV ст.). Крім Франції, миловаріння в Європі розвивалося в Італії, Греції, Іспанії, на Кіпрі, тобто в районах, де культивуються маслинові дерева. Перші німецькі миловарні були засновані в XIV ст.
Незважаючи на те що наприкінці епохи середньовіччя в різних країнах існувала досить розвинена миловарна промисловість, хімічна сутність процесів, звичайно ж, була незрозумілою. Лише на межі XVIII і XIX ст. було з’ясовано хімічну природу жирів і пояснено реакцію їхнього омилення. У 1779 р. шведський хімік Шеєле показав, що внаслідок взаємодії маслинової олії з оксидом Плюмбуму й водою утворюється солодка й розчинна у воді речовина. Вирішальний крок на шляху вивчення хімічної природи жирів зробив французький хімік Шеврель. Він відкрив стеаринову, пальмітинову й олеїнову кислоти як продукти розкладання жирів у процесі їх омилення водою й лугами. Солодку речовину, одержану Шеєле, Шеврель назвав гліцерином. Сорок років по тому Бертло встановив природу гліцерину й пояснив хімічну будову жирів.
У побуті, не кажучи вже про промисловість, миють різні предмети й об’єкти. Існують найрізноманітніші забруднюючі речовини, але найчастіше вони погано розчиняються або взагалі не розчиняються у воді. Такі речовини зазвичай є гідрофобними, оскільки водою не змочуються і з водою не взаємодіють. Тож потрібні різні мийні засоби.
Якщо спробувати дати визначення, то миттям можна назвати очищення забрудненої поверхні рідиною, що містить мийну речовину або систему мийних речовин. Як рідину в побуті використовують переважно воду. Хороша мийна система має виконувати подвійну функцію: видаляти забруднення з поверхні, яку потрібно очистити, і переводити його у водний розчин. Отже, мийний засіб також повинен мати здатність взаємодіяти із забруднюючою речовиною й переводити її у воду або водний розчин. Тож молекула мийної речовини має містити гідрофобну й гідрофільну частини. Фобос грецькою – “страх”, “острах”. Виходить, гідрофобність означає “той, що боїться, уникає води”. Філео грецькою – “люблю”, а “гідрофільність” – “той, що любить, утримує воду”. Гідрофобна частина молекули мийної речовини має здатність взаємодіяти з поверхнею гідрофобної забруднюючої речовини. Гідрофільна частина мийної речовини взаємодіє з водою, проникає у воду й захоплює із собою частинку забруднюючої речовини, приєднану до гідрофобного кінця.
Отже, мийні речовини повинні мати здатність адсорбуватися на поверхні розділення фаз, тобто мати поверхневу активність. їх називають поверхнево-активними речовинами (ПАР).
Виробництво мила
Солі важких карбонових кислот, наприклад CH3(CH2)14COONa, є типовими поверхнево-активними речовинами. Вони містять гідрофільну частину (у цьому випадку – карбоксильну групу) і гідрофобну частину (вуглеводневий радикал).
Тваринні жири – давня й досить цінна сировина миловарної промисловості. Вони містять до 40 % (насичених) жирних кислот. Штучні, тобто синтетичні, жирні кислоти одержують з парафіну нафти шляхом каталітичного окиснення киснем повітря. У спрощеній формі реакцію можна описати таким рівнянням:
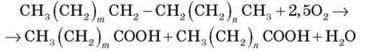
Молекула парафіну внаслідок окиснення розривається в різних місцях, через що утворюється суміш кислот, які поділяються на фракції. У виробництві мила використовують дві фракції: C10 – C16 і C17 – C20. У господарське мило синтетичні кислоти вводять у кількості 35-40 %. Для виробництва мила також застосовують нафтенові кислоти, що виділяють у процесі очищення нафтопродуктів (бензину, гасу та ін.). Для цього нафтопродукти обробляють розчином натрій гідроксиду, одержуючи водний розчин натрієвих солей нафтенових кислот (монокарбонові кислоти ряду циклопентану й циклогексану). Цей розчин упарюють і обробляють кухонною сіллю, у результаті чого на поверхню розчину спливає мазеподібна маса темного кольору – милонафт. Для очищення милонафт обробляють сульфатною кислотою, тобто витісняють із солей нафтенові кислоти. Цей нерозчинний у воді продукт називають асидолом, або асидол-милонафтом. Безпосередньо з асидолу можна виготовляти лише рідке або, у крайньому випадку, м’яке мило. Воно пахне нафтою, зате має бактерицидні властивості.
У виробництві мила давно використовують каніфоль, яку одержують у процесі переробки живиці хвойних дерев. Каніфоль складається із суміші смоляних кислот, що містять у ланцюзі близько двадцяти атомів Карбону. До рецептури господарського мила зазвичай додають 12-15 % каніфолі від маси жирних кислот, а до рецептури туалетних мил – не більш ніж 10 %. Уведення каніфолі у великих кількостях робить мило м’яким і липким.
Процес виробництва мила складається з хімічної та механічної стадій. На першій стадії (варіння мила) одержують водний розчин солей Натрію (рідше – Калію) жирних кислот або їхніх замінників (нафтенових, смоляних). На другій стадії здійснюють механічну обробку цих солей – охолодження, сушіння, змішування з різними добавками, обробку й пакування.
Варіння мила завершують обробкою мильного розчину (мильного клею) надлишком лугу (NaOH) або розчином NaCl. У результаті цього на поверхню розчину спливає концентрований шар мила, що називається ядром. Одержане в такий спосіб мило називають ядровим, а процес його виділення з розчину – відсолкою або висалюванням. Під час висалювання відбувається підвищення концентрації мила та його очищення від білкових, барвних і механічних домішок – так одержують господарське мило.
Якщо мило виготовляють із тваринних або рослинних жирів, то з розчину після відокремлення ядра виділяють гліцерин, що утворюється в результаті омилення. Він має широке й різноманітне застосування: у виробництві вибухових речовин (тринітрогліцерин) і полімерних смол; як пом’якшувач тканин і шкіри; для парфумерних, косметичних і медичних препаратів; у виробництві кондитерських виробів і лікерів. Останнім він надає грузлої консистенції.
Для одержання особливо чистого і світлого мила його очищують (шліфують): знову переводять у розчин, кип’ятять з гарячою водою й удруге висалюють. У результаті шліфування мило набуває більшої однорідності, низької в’язкості й належної пластичності. Для виготовлення туалетного мила в очищеному ядровому милі знижують уміст води від 30 до 12 %. Потім у нього додають парфумерні віддушки, підбілювач типу TiО2, барвники та ін. Гарні сорти туалетного мила містять до 50 % мила, одержаного з імпортної кокосової або пальмової олії. Кокосова олія добре розчиняється в холодній воді й характеризується високим піноутворенням. Іноді туалетне мило містить до 10 % вільних жирних кислот. Найдорожче туалетне мило цілком виготовляють із кокосової олії.
Для поліпшення деяких характеристик господарського мила (а іноді й туалетного), а також для здешевлення в нього вводять наповнювачі. До них належать деякі натрієві солі (Na2CO3, Na2B4O7, Na5P3O10, рідке скло), які внаслідок розчинення у воді приводять до підлужування, клеї (казеїн, казеїновий холодець), вуглеводи (крохмаль). Клеї та крохмаль сприяють піноутворенню мильного розчину і стійкості піни, однак мийної здатності не мають. Для одержання паст у рідке господарське мило додають тонкоподрібнений пісок, товчену цеглу, жирні глини. Вони сприяють механічному очищенню. Такі мила застосовують для чищення кухонного посуду, нефарбованих меблів, підлог тощо.
Особливе місце серед наповнювачів посідає сапонін, одержуваний шляхом вилуговування деяких рослин, насамперед мильного кореня. Він добре розчиняється у воді, а його розчини добре піняться, тому сапонін використовують для поліпшення піно-утворення й застосовують для дорогих сортів мил.
Слід відзначити, що заміна Натрію на Калій змінює консистенцію мила. З твердого воно стає м’яким або мазеподібним.
Іони Кальцію й Магнію утворюють з аніонами важких карбонових кислот малорозчинні солі. Цей процес можна описати рівняннями:
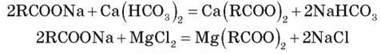
Через це в разі прання білизни у твердій воді, що містить ці іони, витрати мила підвищуються на 25-30 %. Малорозчинні солі Кальцію й Магнію осідають на тканині, забивають пори й роблять тканину цупкою, менш еластичною, з поганою повітро – й вологопроникністю. Такі тканини набувають сіруватого відтінку, а їхні фарби блякнуть. Крім цього, осілі на тканині вапняні мила призводять до зниження її міцності. Це відбувається тому, що аніони ненасичених карбонових кислот під час сушіння тканин окислюються киснем повітря з утворенням речовин пероксидного характеру. Вони ж окиснюють целюлозу, з якої складаються тканини. Для усунення шкідливих наслідків твердої води в мила додають натрійтрифосфат Na5P3O10. Аніон P3O105- зв’язує іони Ca2+ і Mg2+ у міцні, але розчинні у воді сполуки. По суті, вони відіграють роль пом’якшувача води. З цією ж метою натрійтрифосфат та інші поліфосфатні аніони додають і в пральні порошки.
Крім використання мила як мийного засобу його широко використовують в обробці тканин, виробництві косметичних засобів, виготовленні полірувальних сумішей і виробництві водоемульсійних фарб. Існують також і не настільки небезпечні способи його застосування. Алюмінієве мило (алюмінієві солі суміші жирних і нафтенових кислот) застосовують у США для одержання деяких видів напалму – самозаймистої сполуки, що використовується у вогнеметах і запальних авіабомбах. Слово “напалм” походить від початкових складів назв нафтенової й пальмітинової кислот. Склад напалму досить простий – це бензин, загущений алюмінієвим милом.
Синтетичні мийні засоби
Наразі хімічна промисловість виробляє чималу кількість різних синтетичних мийних засобів (пральних порошків). Найбільше практичне значення мають сполуки, що містять насичений вуглеводневий ланцюг з 10-15 атомів Карбону, так чи інакше зв’язаний із сульфатною або сульфонатною групою, наприклад:
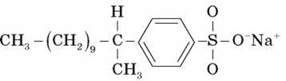
Виробництво синтетичних мийних засобів базується на дешевій сировинній базі, точніше – на продуктах переробки нафти й газу. Вони зазвичай не утворюють малорозчинних у воді солей Кальцію й Магнію.
Отже, багато які із синтетичних мийних засобів однаково добре миють як у м’якій, так і у твердій воді. Деякі засоби придатні для прання навіть у морській воді. Синтетичні мийні засоби діють не лише в гарячій воді, як це відбувається з господарським милом, але й у воді з порівняно низькими температурами, що важливо для прання тканин зі штучних волокон. Зрештою, концентрація синтетичних мийних речовин навіть у м’якій воді може бути набагато меншою, ніж концентрація мила, одержаного з жирів. Синтетичні мийні засоби зазвичай є досить складною композицією, оскільки до їхнього складу входять різні добавки: оптичні підбілювачі, хімічні підбілювачі, ферменти, піноутворювачі, пом’якшувачі.
IV. Первинне застосування одержаних знань
Керована практика
Порівняймо мийну дію господарського мила й СМЗ.
Лабораторний дослід 10. Порівняння властивостей мила й синтетичних мийних засобів
Завдання 1. Які сполуки в разі взаємодії зі стеариновою кислотою утворять мило: натрій гідроксид, кальцій гідроксид, натрій карбонат, кальцій карбонат? Напишіть рівняння можливих реакцій.
Завдання 2. Якщо на розчин мила подіяти сульфатною кислотою, то на поверхню спливає тверда нерозчинна у воді речовина. Складіть рівняння реакції й назвіть цю речовину.
Завдання 3. Калій стеарат – найважливіший компонент рідкого мила. Обчисліть масу калій гідроксиду і тристеарату, що знадобиться для одержання калій стеарату масою B00 кг, якщо масова частка виходу продукту становить 80 % через виробничі втрати.
Завдання 4*. Щоб обчислити кількість зв’язаного в милі лугу, 2 г мила розчинили у воді й нейтралізували 30 мл 0,1М розчину сульфатної кислоти. Обчисліть масову частку лугу в милі.
V. Підбиття підсумків уроку
Підбиваємо підсумки уроку, оцінюємо роботу учнів на уроці.
VI. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи.
Додаткове завдання: подумайте й запропонуйте заходи щодо охорони навколишнього середовища від забруднення мийними засобами.