Нейтралізація слабких кислот і основ – Нейтралізація
КИСЛОТИ Й ОСНОВИ
3. Нейтралізація
При змішуванні рівних об’ємів соляної кислоти і розчину їдкого натру однакових концентрацій, утворюється нейтральний розчин натрій хлориду, що має показник pH = 7. Таким чином, кислотні і лужні властивості початкових речовин нейтралізуються.
Нейтралізація є реакцією взаємодії іонів гідроксонію і гідроксид-іонів з утворенням молекул води:
Н3О+ + ОН –  2 Н2О.
2 Н2О.
Увага: рівновага практично повністю зміщена в бік утворення води (автопротоліз води).
Аніон кислоти (наприклад,
3.1. Нейтралізація слабких кислот і основ
Слабкі кислоти й основи при нейтралізації поводять себе інакше.
– Оскільки іони гідроксонію і гідроксид-іони під час нейтралізації постійно видаляються з протолітичної рівноваги, то їх концентрація повинна поновлюватися в рівному об’ємі за рахунок дисоціації слабких електролітів.
– Розчин солі, утворений в результаті проведеної
Приклад 1. У водному розчині етанової кислоти міститься невелика кількість іонів гідроксонію. При нейтралізації з використанням розчину їдкого натру ці іони видаляються з рівноваги і тому поповнюються за рахунок дисоціації молекул етанової кислоти. Після проведення нейтралізації утворений розчин натрій ацетату має лужне середовище, оскільки ацетат-іон вступає в реакцію з водою:
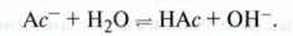
Приклад 2. У водному розчині амоніаку міститься невелика кількість гідроксид-іонів. Під час нейтралізації з використанням хлоридної кислоти ці іони видаляються з рівноваги і тому поповнюються за рахунок протолізу молекул амоніаку. Розчин амоній хлориду, утворений в результаті нейтралізації, має кисле середовище, оскільки іон амонію вступає в реакцію з водою:
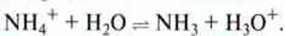
Зміни значення pH розчину при додаванні кислоти або лугу представлені у вигляді кривої титрування.
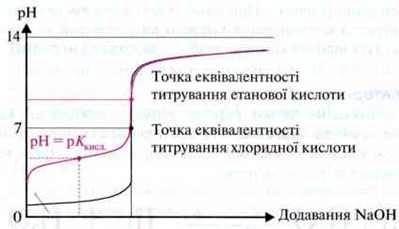
Запам’ятайте: точкою еквівалентності називають точку на кривій титрування за відсутності надлишку як кислоти, так і лугу. При титруванні слабкої кислоти точка еквівалентності на кривій титрування знаходиться в лужній області значень pH, при титруванні слабкої основи розчином сильної кислоти точка еквівалентності знаходиться в кислій області значень pH.
На кривій титрування слабких кислот і основ, окрім точки еквівалентності, є ще поворотна точка. У цьому місці відбувається перетворення половини кислоти або основи на відповідну зв’язану основу або кислоту. Оскільки в цьому випадку утворюється буферний розчин у співвідношенні концентрацій сіль : кислота або сіль : основа, рівному 1:1, то значення pH або значення рОН, відповідно до буферного рівняння, відповідає значенню рКкисл. або значенню рКосн. кислоти чи основи.
Увага: криві титрування багатоосновних кислот, молекули яких можуть дисоціювати ступінчасто, мають відповідно більше точок еквівалентності.
