Оксид та гідроксид алюмінію – МЕТАЛИ ГОЛОВНИХ ПІДГРУП
ПОСІБНИК З ХІМІЇ ДЛЯ ВСТУПНИКІВ ДО ВИЩИХ НАВЧАЛЬНИХ ЗАКЛАДІВ
Частина II. НЕОРГАНІЧНА ХІМІЯ
Розділ 13. МЕТАЛИ ГОЛОВНИХ ПІДГРУП
§ 13.12. Оксид та гідроксид алюмінію
Оксид алюмінію (глинозем) Аl2О3 – речовина білого кольору, досить тугоплавка, з дуже високою твердістю. Є вихідним продуктом для добування алюмінію. У природі трапляється у вигляді корунду та його різновидів. Якщо безбарвні кристали корунду забарвлені домішками в синій колір, вони називаються сапфірами, у фіолетовий – аметистами, у червоний – рубінами. Кристали рубінів
У лабораторії оксид алюмінію добувають спалюванням алюмінію у кисні або прожарюванням гідроксиду алюмінію: 4Аl + 3O2 = 2Аl2О3; 2Аl(ОН)3 = Аl2О3 + ЗН2О.
У промисловості, як уже зазначалося, його добувають з бокситів або нефелінів.
Оксид алюмінію не розчиняється у воді і з нею не реагує. Він амфотерний – взаємодіє з кислотами (правда, важко) і лугами:
А) з хлоридною кислотою:
Аl2О3 + 6НСl = 2АlСlЗ + ЗН2O;
Б) при сплавлянні з твердим гідроксидом натрію:
Аl2О3 + 2NaOH = 2NaAlO2 + Н2О;
В) з розчином гідроксиду натрію:
Аl2О3 + 2NaOH + 7Н2О = 2Na
Або
Аl2О3
Розчинення амфотерних гідроксидів у лужних розчинах розглядають як процес утворення гідроксосолей (гідроксоком плексів). Експериментально доведено існування гідроксокомплексів
-, 3-, 2-;
З них перший – найстійкіший. Координаційне число алюмінію в цьому комплексі дорівнює 6, тобто алюміній є шестикоординованим:
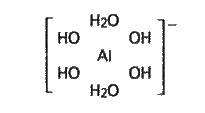
Тому взаємодію гідроксиду алюмінію з розчином лугу слід зображати рівнянням (в).
Дисоціацію амфотерного гідроксиду алюмінію у водному розчині точніше можна виразити рівнянням:
Аl3+ + 3ОН – ⇆ Аl(OН)3 = Аl(OН)3 + 3Н2О ⇆ + H+.
Гідроксид алюмінію Аl(OН)3 – біла тверда речовина, у воді практично нерозчинна. Добувають його непрямим способом – із солей алюмінію дією на них розчинами лугів:
АlСl3 + 3NaOH = Аl(OН)3 ↓ + 3NaCl
Або
Al3+ +3OН – = Аl(OН)3 ↓.
Аl(ОН)3 – типовий амфотерний гідроксид. При взаємодії з кислотами утворює солі, що містять катіони алюмінію; при взаємодії з розчинами лугів (взятими у надлишку) утворює алюмінати, тобто солі, в яких алюміній входить до складу аніона. Наприклад:
Аl(ОН)3 + ЗН+ = Аl3+ + ЗН2О;
Аl(ОН)3 + ОН – + 2Н2O = -.
Як видно з рівняння дисоціації Аl(ОН)3, при надлишку іонів Н+ (тобто в кислому середовищі) у водному розчині переважають іони Аl, а у лужному середовищі утворюється переважно однозарядний аніон, він же і найстійкіший.