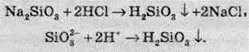Оксиди Карбону та Силіцію – КАРБОН. СИЛІЦІЙ
Хімія підготовка до ЗНО та ДПА
Комплексне видання
ЧАСТИНА І
ЗАГАЛЬНА ХІМІЯ
ХІМІЯ ЕЛЕМЕНТІВ
КАРБОН. СИЛІЦІЙ
Оксиди Карбону та Силіцію
Карбон(ІІ) оксид
У молекулі карбон мснооксиду (чадного газу) СО атоми Карбону й Оксигену зв’язані потрійним зв’язком: два зв’язки утворені за ковалентним механізмом, а третій – за донорно-акцепторним:

Фізичні й біологічні властивості
Чадний газ являє собою безбарвний газ із досить низькими температурами плавлення та кипіння: Тпл = -205
Добування карбон монооксиду
У промислових масштабах карбон монооксид добувають взаємодією вуглекислого газу СО2 з розжареним вугіллям:

Невеликі кількості чадного газу в лабораторіях добувають шляхом розкладання мурашиної або щавлевої кислоти під дією гарячої концентрованої сульфатної кислоти:

Хімічні властивості карбон моно оксиду
СО є гарним відновником. Величезні кількості чадного газу застосовують у металургійній промисловості для добування чистих металів:
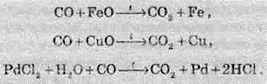
Для карбон монооксиду характерні реакції приєднання. Наприклад, при нагріванні з хлором, амоніаком та деякими іншими речовинами:
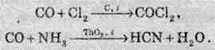
Карбон монооксид є несолетворним оксидом, він не взаємодіє з водою, кислотами й лугами. При нагріванні суміші карбон(ІІ) оксиду з киснем утворюється карбон діоксид:

Застосування карбон(ІІ) оксиду
Карбон монооксид застосовують у металургії як відновник металічних руд. Перспективним є також застосування СО як гарного газуватого палива.
Карбон(І V ) оксид
Карбон діоксид за нормальних умов являє собою безбарвний газ із близькими температурами плавлення та кипіння: Тпл = -78,5 °С; Ткип = -56,5 °С. Він помірно розчинний у воді: 1,7 літрів вуглекислого газу розчиняються в 1 літрі води при температурі +15 °С.
Добування карбон діоксиду
Вуглекислий газ зазвичай добувають спалюванням вуглецю або якого-небудь органічного палива (нафти, газу) в надлишку кисню:
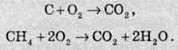
Вуглекислий газ утворюється також у результаті дихання тварин та рослин.
Хімічні властивості карбон діоксиду
При розчиненні вуглекислого газу у воді утворюється нестійка карбонатна кислота. При спробі виділити її з розчину карбонатна кислота розкладається на воду та вуглекислий газ, тобто процес утворення кислоти оборотний:
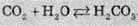
Карбонатна кислота є слабкою двохосновною кислотою (Ка1 =1,3 ∙ 10-4, Ка2 =5 ∙ 10-11). Схема її дисоціації зображена нижче:
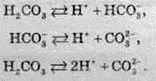
За рахунок утворення кислоти при взаємодії вуглекислого газу з водою, СО2 відносять до кислотних оксидів, тому, карбон діоксид вступає у взаємодію з лугами та основними оксидами з утворенням карбонатів або гідрогеакарбонатів. Карбонати й гідрогенкарбонати – це солі карбонатної кислоти (наприклад, Na2CO3 – натрій карбонат; KHCO3 – гідрогенкарбонат калію). Карбонати добувають так:
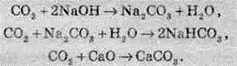
Карбон діоксид не підтримує горіння й дихання.
Для карбон(ІV) оксиду не характерні окисні властивості, але у випадку взаємодії з активними металами карбон діоксид є окисником:
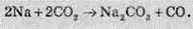
Силіцій оксид
Силіцій оксид при нормальних умовах являє собою склоподібну тверду речовину з високими температурами фазових переходів; Тпл =+1600 °С; Ткип =+2600 °С.
Силіцій оксид, так само, як і карбон(ІV) оксид, є кислотним оксидом, хоча сам він з водою не реагує (це знає кожен, тому що SiO2 – це не що інше, як пісок, а пісок з водою не взаємодіє). Силіцій оксиду відповідає силікатна кислота – H2SiO3. Ця кислота не розчиняється у воді.
При сплавлянні силіцій оксиду з лугами або основними оксидами утворюються силікати. Силікати – це солі силікатної кислоти:
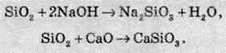
Силікатна кислота являє собою тверду, не розчинну у воді речовину білого кольору, яка при добуванні з концентрованих розчинів утворює сирнистий осад, а з розведених розчинів виділяється у вигляді колоїдного розчину. Колоїдний розчин – це проміжний стан між справжнім розчином і суспензією, а розміри частинок у таких розчинах порядку 10  100 молекул.
100 молекул.
Силікатна кислота – це слабка двохосновна кислота (Ка1 = 2 ∙ 10-10, Ка2 = 2 ∙ 10-12). Її добувають дією на розчинні у воді силікати хлоридною або сульфатною кислотами: