Приготування розчинів
Тема 1
РОЗЧИНИ
Урок 9
Тема уроку. Приготування розчинів
Цілі уроку: формування навичок і вмінь приготування розчинів; розвиток навичок розв’язання задач із використанням поняття “масова частка розчиненої речовини”, розрахунків, пов’язаних із приготуванням розчинів.
Тип уроку: застосування вмінь і навичок.
Форми роботи: самостійна робота під керівництвом учителя, виконання тренувальних завдань.
Обладнання: таблиця розчинності, картки-завдання.
ХІД УРОКУ
I. Організація класу
II. Перевірка домашнього
Актуалізація опорних знань
Заслуховуємо й розв’язуємо задачі, складені учнями.
III. Творче застосування вмінь і навичок
Задача 1
Обчисліть масу кристалогідрату CuSO4 – 5H2O, необхідну для приготування 50 г розчину з масовою часткою купрум(ІІ) сульфату 10 %.
Розв’язання
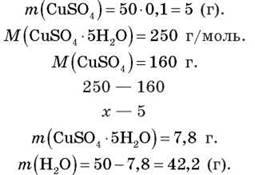
Відповідь: 7,8 г CuSO4 5H2О; 7,8 г води.
Задача 2
Обчисліть масу каустичної соди (кристалогідрату Na2CO3 – 10H2О), необхідної для приготування 100 г розчину з масовою часткою натрій карбонату 20 %.
Розв’язання
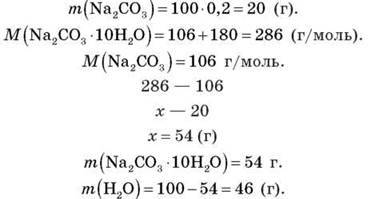
Відповідь: 54 г Na2CО3 – 10H2О; 46 г H2О.
Задача
Обчисліть масу осаду, що утвориться в результаті змішування 120 г 16%-го розчину сульфатної кислоти з барій хлоридом.
Розв’язання
1. Обчислимо масу сульфатної кислоти:
M(H2SO4) = 120 – 0,16 = 19,2 (г).
2. Обчислимо кількість речовини сульфатної кислоти:
V(H2SO4) = 19,2/98 = 0,2 (моль).
3. За рівнянням реакції обчислимо масу осаду:
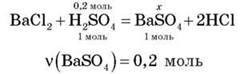
Відповідь: 46,6 г.
Задача 4
Обчисліть масу 20%-го розчину натрій гідроксиду, необхідного для нейтралізації 120 г 35%-го розчину хлоридної кислоти.
Розв’язання
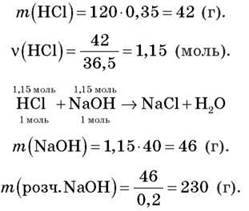
Відповідь: 230 г 20%-го розчину натрій гідроксиду.
Задача 5*
Обчисліть об’єм карбон(IV) оксиду, що виділиться внаслідок зливання двох розчинів: 200 г 20%-го розчину натрій карбонату і 50 г 40%-го розчину сульфатної кислоти.
Розв’язання
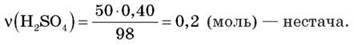
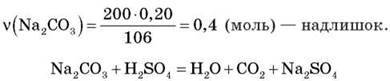
Було | 0,4 моль | 0,2 моль | 0 |
Витратилося | 0,2 моль | 0,2 моль | 0,2 моль |
Залишилося | 0,2 моль | 0 | 0,2 моль |
V(CO2) = 0,2 моль – 22,4 л/моль = 4,48 л.
Задача 5
Для боротьби з комахами-шкідниками використовується розчин купрум(ІІ) сульфату (мідний купорос). Обчисліть кількість речовини й води, що необхідна для приготування 2 кг такого розчину з масовою часткою речовини 35 %.
Задача 6
Оцтова есенція – це розчин оцтової кислоти (CH3COOH) у воді з масовою часткою речовини 80 %. Скільки грамів оцтової есенції та води необхідні для приготування 200 г розчину з масовою часткою речовини 3 %, що називається оцтом і використовується як приправа до страв?
Задача 7
Для поливання квітів приготували 1000 г розчину калій нітрату з масовою часткою речовини 2 %. За час зберігання в жаркому приміщенні з розчину випарувалося 2 г води. Обчисліть масову частку речовини в новому розчині.
IV. Підбиття підсумків уроку
Сьогодні ми навчилися використовувати поняття масової частки розчиненої речовини в розчині для розрахунків, пов’язаних із приготуванням розчинів та їх використанням.
V. Домашнє завдання
Повторити матеріал підручника, підготуватися до практичної роботи № 1, повторити правила техніки безпеки під час роботи в кабінеті хімії.