Приклади розв’язування типових задач – Урок 4
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ
3. Хімічний зв’язок
Приклади розв’язування типових задач
Задача 1. Визначте ступені окиснення Фосфору в таких сполуках: К3Р, Na3PO4, К4Р2O7, Р2O5, Н3РO3.
Розв’язання
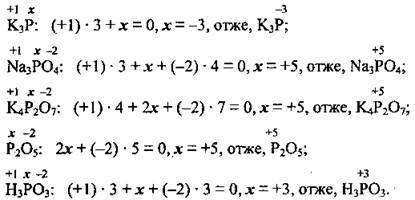
Задача 2. Визначте ступені окиснення Сульфуру в сполуках Na2SO3, Al2(SO4)3, Na2S2O3, SO2, SO3.
Розв’язання
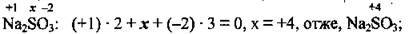
Al2(SO4)3. Для встановлення ступеня окиснення Сульфуру можна піти двома шляхами:
1) записати формулу солі
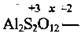 і скласти рівняння:
і скласти рівняння: 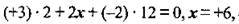 або
або2) визначити ступінь окиснення Сульфуру з формули сульфатної кислоти. Адже ступінь окиснення Сульфуру в кислотному залишку в будь-якій солі цієї кислоти має те саме значення:
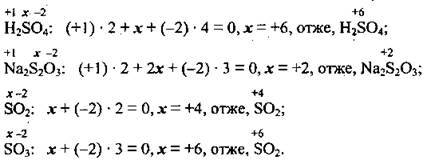
Знаючи ступінь окиснення елементів, що є в складі складних речовин, можна скласти відповідні формули.
Задача 3. Складіть формулу сполуки Магнію з Фосфором.
Розв’язання
Магній – це металічний елемент II групи головної підгрупи, якому властивий лише один ступінь окиснення – +2. Фосфор – це неметалічний елемент
Отже, підставивши ступені окиснення Mg і Р у формулу MgxPy встановлюємо індекси х і у: 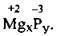
А далі діємо так само, як і при складанні формул: за валентністю знаходимо найменше спільне кратне (число, яке ділиться без залишку) і ділимо на значення ступеня окиснення кожного з елементів. У наведеному прикладі це число дорівнює 6. Ділимо його на 2, отримуємо індекс, тобто 3. Ділимо 6 на 3, маємо значення індексу у, тобто у = 2. Отже, формула магній фосфіду будеMg3P2.
Задача 4. Визначте ступінь окиснення Фосфору у дигідрогенфосфат-йоні Н2РО4-.
Розв’язання
Ступінь окиснення Гідрогену – +1, Оксигену – -2, а арифметична сума ступенів окиснення елементів у йоні дорівнює заряду йона. Позначивши ступінь окиснення Фосфору за х, маємо:
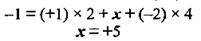
Отже, ступінь окиснення Фосфору у дигідрогенфосфат-йоні – +5.
Задача 5. Складіть формулу бінарної сполуки Карбону із Сульфуром.
Розв’язання
Сульфур розміщений у головній підгрупі VI групи, конфігурація електронних оболонок 1s22s22p23s22p4. Сульфур є більш електронегативним елементом. До завершення зовнішнього електронного шару йому не вистачає 2 електронів, у сполуці з Карбоном він виявляє ступінь окиснення -2. Карбон розміщений у головній підгрупі IV групи, конфігурація електронних оболонок 1s22s22p2. Карбон виявляє ступінь окиснення +4. Установлюємо індекси х і у:
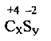
Знаходимо найменше спільне кратне для 4 і 2 – 4. Ділимо його на значення ступенів окиснення відповідних елементів, отримуємо індекси 1 і 2. Отже, формула речовини – C2S(карбон(ІV) сульфід).