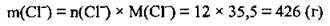Приклади розв’язування типових задач – Урок 7
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ
6. Суміші речовин. Розчини
Приклади розв’язування типових задач
Задача 1. Складіть молекулярне рівняння, що відповідає такому скороченому йонно-молекулярному рівнянню:
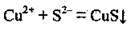
Розв’язання
Йонно-молекулярне рівняння реакції показує, що під час реакції відбулось зв’язування йонів Купруму Сu2+ і сульфід-іонів S2- в нерозчинну сполуку купрум(ІІ) сульфід CuS, тобто фактично реакція відбулась між йонами
Від першого варіанта відмовимося зразу, оскільки купрум(ІІ) гідроксид є нерозчинною основою і не дисоціює з утворенням йона Сu2+. Другий варіант так Само неприйнятний, оскільки сірководень H2S погано розчиняється у воді й сірководнева кислота виявляє низький ступінь дисоціації (К = 6,9 · 10-7 моль/л). Відповідно в розчині міститься незначна кількість сульфід-іонів, отже, така реакція не відбудеться. Зупинимось
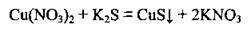
А тепер складемо йонно-молекулярні рівняння:
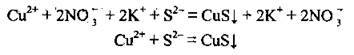
Одержаний результат засвідчує правильність добору солей і написання молекулярного рівняння.
Задача 2. Укажіть пару формул речовин, які потрібно використати, щоб реакція відбулась відповідно до йонно-молекулярного рівняння:
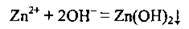
A Zn і Н2O
Б ZnO і Н2O
В Zn3(PO4)2 і КОН
Г Zn(NO3)2 і NaOH
Розв’язання
Наведене йонно-молекулярне рівняння показує, що, сутність реакції зводиться до зв’язування йонів Zn2+ і OН-. Йони Zn2+ у розчині можуть утворитися лише завдяки дисоціації солей Цинку, які розчинні у воді. Оскільки Zn3(PО4)2 у воді не розчиняється, годиться лише варіант Г (Zn(NО3)2). А йони ОН – утворюються при дисоціації лугів (NaOH):
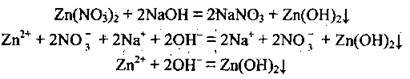
Задача 3. Укажіть йони, які можуть одночасно міститись у розчині:
А Ва2+ і SO42-
Б Ag+ і Сl –
В Na+ і SO42-
Г Ag+ і S2-
Розв’язання
Йони Na+ і SO42- можуть міститись у розчині одночасно, як завгодно довго, тому що вони не зв’язуються в осад, газ чи малодисоційовану речовину, на відміну від інших пар йонів:
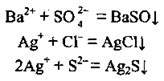
Правильною є відповідь В.
Задача 4. Укажіть йони, які не можуть одночасно міститись у розчині:
A NH4+ і SO42-
Б NH4+ і Сl –
B Mg2+ i PO43-
Г К+ і PO43-
Розв’язання
Іони, які, взаємодіючи, утворюють газ, осад чи малодисоційовану речовину, не можуть одночасно міститись у розчині. Іони Mg2+ і РО43- зв’язуються в нерозчинну у воді сіль:
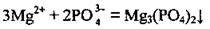
Правильною буде відповідь В.
Задача 5. Укажіть масу хлорид-іонів у розчині алюміній хлориду із вмістом солі 4 моль/л. Вважати, що сіль зазнає повної дисоціації.
Розв’язання
1. Напишемо рівняння дисоціації солі:
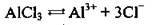
З рівняння видно, що під час дисоціації 1 моль солі утворюється 3 моль хлорид-іонів. Відповідно під час дисоціації 4 моль АlСl3 утвориться 12 моль йонів хлору (Сl-). Для обчислення маси йонів скористаємося формулою:
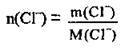
2. З формули обчислюємо масу йонів. М(Сl-) = 35,5 г/моль: