Приклади розв’язування типових задач – Урок 8
ХІМІЯ – Комплексна підготовка до зовнішнього незалежного оцінювання
РОЗДІЛ І. ЗАГАЛЬНА ХІМІЯ
6. Суміші речовин. Розчини
Приклади розв’язування типових задач
Задача 1. Обчисліть масову частку калій гідроксиду (%) в розчині, одержаному при розчиненні 0,75 моль калій оксиду в 180 мл води.
Дано:
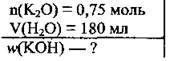
Розв’язання
1. Складемо рівняння реакції і, склавши пропорцію, розрахуємо кількість речовини лугу n(КОН), що утворився:
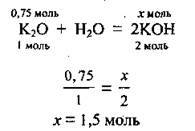
2. За формулою 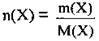 розрахуємо
розрахуємо
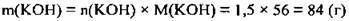
3. Для знаходження маси розчину треба визначити маси К2O і води. М(К2O) = 94 г/моль, ρ(Н2O) = 1 г/мл:
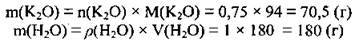
4. Обчислимо масу розчину:
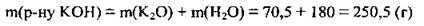
5. За формулою 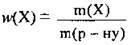 обчислимо масову частку лугу в одержаному розчині:
обчислимо масову частку лугу в одержаному розчині:
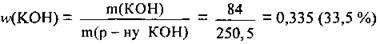
Відповідь: w(KOH) = 33,5 %.
Задача 2. У 39,6 мл води розчинили 0,2 моль сульфур(VІ) оксиду. Укажіть кількість речовини води і одержаному розчині.
Дано:
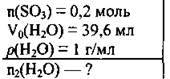
Розв’язання
1. Обчислимо масу води, у якій розчинили SO3:
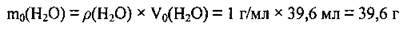
2. Сульфур(VІ) оксид – кислотний оксид, а тому при розчиненні його у воді утворюється сульфатна кислота. За рівнянням реакції розрахуємо кількість речовини води n1(Н2O), яка хімічно зв’язалась із SO3:
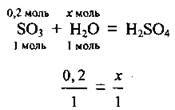
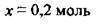
3. Обчислимо масу цієї хімічно зв’язаної води (М(Н2O) = 18 г/ моль):
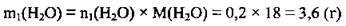
4. Знайдемо масу води m2(Н2O), яка залишилася в розчині:
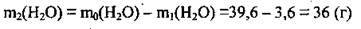
5. Розрахуємо кількість речовини води:
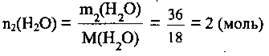
Відповідь: n2(Н2O) = 2 моль.
Задача 3. У надлишок розчину сульфатної кислоти помістили 35,2 г суміші міді та заліза. Виділилось 8,96 л газу. Обчисліть масову частку міді (%) у суміші.
Дано:
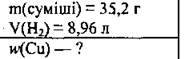
Розв’язання
Мідь не взаємодіє, оскільки розміщується у витискувальному ряду металів справа від водню:
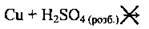
З розбавленою сульфатною кислотою взаємодіє лише залізо. За рівнянням реакції обчислимо масу заліза в суміші (VM = 22,4 л/моль):
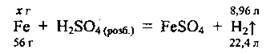
1. За рівнянням реакції складемо пропорцію і проведемо розрахунок маси заліза m(Fe):
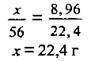
2. Визначимо масу міді в суміші металів:
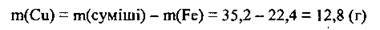
3. Обчислимо масову частку міді в суміші:
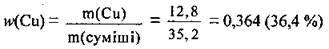
Відповідь: w(Сu) = 36,4 %.
Задача 4. На розчинення 37,8 г суміші алюмінію і срібла витратили 219 г хлоридної кислоти з масовою часткою хлороводню 0,2. Обчисліть масу срібла в суміші.
Дано:
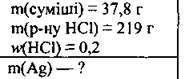
Розв’язання
Срібло із хлоридною кислотою не взаємодіє, оскільки у витискувальному ряду металів розташоване справа від водню, з кислотою реагує лише алюміній:
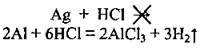
1. Розрахуємо масу хлороводню в кислоті:
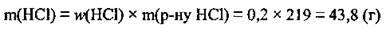
2. За рівнянням реакції Складемо пропорцію і розрахуємо масу алюмінію (М(НСl) = 36,5 г/моль):
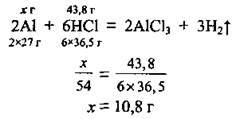
3. Обчислимо масу срібла у вихідній суміші:
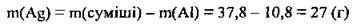
Відповідь: m(Ag) = 21 т.
Задача 5. Укажіть об’єм води, який потрібно додати до 200 г розчину калій сульфату з масовою часткою солі 20 %, щоб одержати розчин, у якому масова частка солі становитиме 12,5 %
Дано:
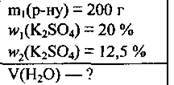
Розв’язання
1. Обчислимо масу солі у 200 г початкового розчину:
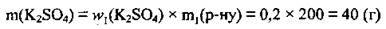
2. Масу доданої води позначимо х г, тоді маса розчину становитиме:
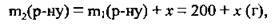
А маса солі залишиться незмінною:
M(K2SО4) = 40 г
3. Підставимо всі відомі значення у формулу для розрахунку масової частки 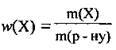 і обчислимо масу доданої води х:
і обчислимо масу доданої води х:
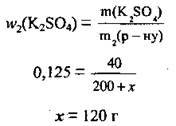
4. За формулою 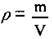 розрахуємо об’єм використаної води. ρ(Н2О) = 1 г/мл:
розрахуємо об’єм використаної води. ρ(Н2О) = 1 г/мл:
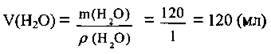
Відповідь: V(H2О) = 120 мл.
Задача 6. У 300 г розчину СuСl2 з масовою часткою солі 15 % розчинили 0,08 моль купрум(ІІ) хлориду. Обчисліть масову частку купрум(II) хлориду в одержаному розчині.
Дано:
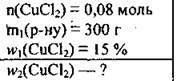
Розв’язання
1. Обчислимо масу солі в 300 г розчину:
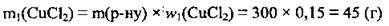
2. Визначимо масу 0,08 моль CuCl2. М(СuСl2) =135 г/моль:
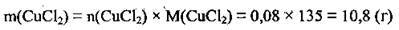
3. Обчислимо загальну масу солі в одержаному розчині:
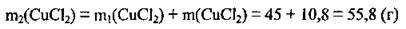
4. Знайдемо масу одержаного розчину:
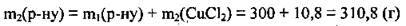
5. Обчислимо масову частку солі:
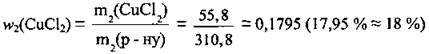
Відповідь: w2(СuСl2) = 18 %.
Задача 7. У 300 г води розчинили 0,2 моль купрум(ІІ) сульфату пентагідрату. Обчисліть масову частку купрум(ІІ) сульфату (%) в цьому розчині.
Дано:
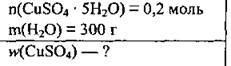
Розв’язання
1. При розчиненні кристалогідрату у воді кристалізаційна вода переходить у розчин:
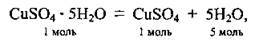
А кількість речовини купрум(ІІ) сульфату, як видно з рівняння, залишається незмінною і збігається і кількістю речовини кристалогідрату:
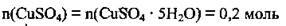
2. За формулою 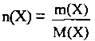 розрахуємо маси кристалогідрату і купрум(ІІ) сульфату. M(CuSO4) = 160 г/моль, M(CuSO4 · 5Н2O) = 250 г/моль:
розрахуємо маси кристалогідрату і купрум(ІІ) сульфату. M(CuSO4) = 160 г/моль, M(CuSO4 · 5Н2O) = 250 г/моль:
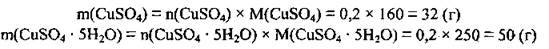
3. Обчислимо масу розчину:
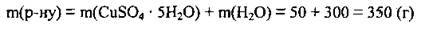
4. Визначимо масову частку купрум(II) сульфату в розчині:
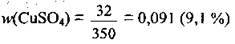
Відповідь: w(CuSO4) = 9,1%.
Задача 8. Яку масу бромної води з масовою часткою брому 15% потрібно використати на реакцію із 13,44 л суміші етану й етену, об’ємна частка етану в якій 66,67 %?
Дано:
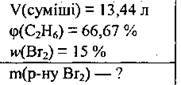
Розв’язання
1. За формулою 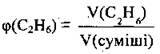 обчислимо об’єм етану в суміші:
обчислимо об’єм етану в суміші:
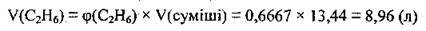
2. Із бромною водою реагує лише етен, а тому обчислимо його об’єм:
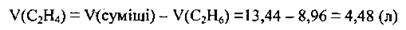
3. Запишемо рівняння; реакції етену з бромною водою, складемо пропорцію і розрахуємо масу брому. М(Вr2) = 160 г/моль, VM = 22,4 л/моль:
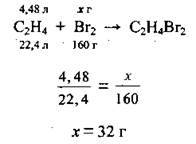
4. За формулою 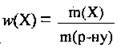 обчислимо масу бромної води:
обчислимо масу бромної води:
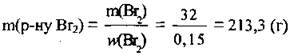
Відповідь: m(р-ну Br2) = 213,13 г.
Задача 9. Визначте масу ферум(ІІ) сульфату гептагідрату, яку потрібно використати для отримання 304 г розчину з масовою часткою ферум(ІІ) сульфату 10 %.
Дано:
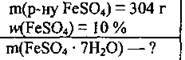
Розв’язання
1. За формулою 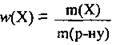 обчислимо масу солі в розчині:
обчислимо масу солі в розчині:
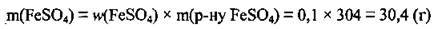
2. При розчиненні у воді кристалогідрат руйнується:
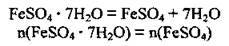
За формулою 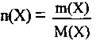 обчислимо кількість речовини солі. M(FeSО4) = 152 г/моль:
обчислимо кількість речовини солі. M(FeSО4) = 152 г/моль:
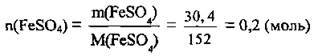
3. Визначимо масу ферум(ІІ) сульфату гептагідрату. M(FeSО4 · 7Н2О) = 278 г/моль:
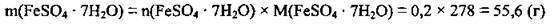
Відповідь: m(FeSО4 · 7Н2О) = 55,6 г.
Задача 10. На повну нейтралізацію 49 г розчину сульфатної кислоти витратили 200 г розчину калій гідроксиду з масовою часткою лугу 5,6 %. Обчисліть масову частку кислоти (%) у розчині.
Дано:
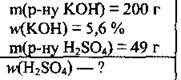
Розв’язання
1. За формулою 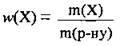 обчислимо масу калій гідроксиду в розчині лугу:
обчислимо масу калій гідроксиду в розчині лугу:
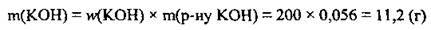
2. Запишемо рівняння реакції, складемо пропорцію і проведемо розрахунки на знаходження маси сульфатної кислоти, яка буде в розчині. M(H2SО4) = 98 г/моль, М(КОН) = 56 г/моль:
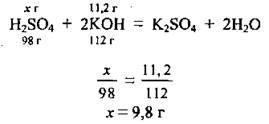
3. За формулою 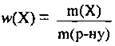 обчислимо масову частку кислоти в розчині:
обчислимо масову частку кислоти в розчині:
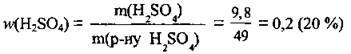
Відповідь: w(H2SO4) = 20 %.